Ammoniy paratungstati - Ammonium paratungstate
 | |
| Identifikatorlar | |
|---|---|
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.031.228 |
| EC raqami |
|
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| Xususiyatlari | |
| (NH4)10(H2V12O42) · 4H2O | |
| Molyar massa | 3132,2 g / mol |
| Tashqi ko'rinish | Oq qattiq |
| Zichlik | 4.60 g / sm3[1] |
| Qaynatish nuqtasi | 600 ° C da parchalanadi |
| Xavf | |
| GHS piktogrammalari |  |
| GHS signal so'zi | Ogohlantirish |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Ammoniy paratungstati (yoki APT) oq kristaldir tuz kimyoviy formulasi bilan (NH4)10(H2V12O42) · 4H2O. "boshqa volfram mahsulotlari uchun eng muhim xom ashyo" deb ta'riflanadi.[2]
Ishlab chiqarish
Volfram rudalaridan
Volfram odatda bo'lgan ma'danlar oksidlar, volfram eritmasini ko'p ifloslantiruvchi turlar bilan birga berish uchun hazm qilinadi. Ushbu xom ekstrakt kislota qilinadi va davolanadi sulfid ajratmoq molibden trisulfid. Keyinchalik kislotalashdan keyin APT kristallanadi.[2]
Laboratoriya usullari
Agar kaltsiylangan bo'lsa WO3 reflyuksiyasida ishlatiladi ammiak eritmani eritilishini tezlashtirish maqsadga muvofiqdir.
Volfram metalliga o'tish
Ammoniy paratungstatini 600 ° S gacha bo'lgan parchalanish haroratiga qadar qizdiring volfram (VI) oksidi, ushbu ideallashtirilgan tenglamada tasvirlanganidek:
- (NH4)10(H2V12O42) · 4H2O → 12 WO3 + 10 NH3 + 6 H2O
U erdan trioksid atmosferada isitiladi vodorod, elementar volfram:[3]
- WO3 + 3 H2 → W + 3 H2O
Tuzilishi
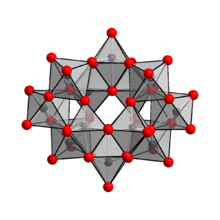
The anion ichida (NH4)10(V12O41) · 5H2O [H ekanligi ko'rsatilgan2V12O42]10−, ikkitadan iborat vodorod atomlari, qafas ichida ikkita vodorod atomini saqlaydi.[1] Shuning uchun ammoniy paratungstati uchun formulaning to'g'ri yozilishi (NH)4)10[H2V12O42] · 4H2O. [H2V12O42]10− ioni paratungstat A ionidan farqli o'laroq [W W formulasiga ega bo'lgan paratungstate B ioni sifatida tanilgan.7O24]6−, paramolizat ioniga o'xshash. Paratungstat A ionining mavjudligini NMR spektroskopiyasi bilan tasdiqlab bo'lmadi.[4]
Taxminan 1930 yilgacha tuzning aniq tarkibi haqida ikkala munozaralar mavjud edi va ikkalasi ham (NH)4)10V12O41 va (NH4)6V7O24 taklif qilingan. O.V. Gibbs bu haqda ta'kidladi:
- "Ishqoriy volframlar juda ko'p va g'ayritabiiy darajada murakkab. Turli xil formulalardagi tuzlar foiz tarkibida shu qadar yaqinlashadiki, tafovutlar tahlillarning muqarrar xatolariga juda yaqin. Tahlillar savolni faqat analitik asoslarga ko'ra hal qilishga deyarli qiyin emas."[5]
Boshqa hidratlar
Ning ammiak eritmasini konsentratsiyalashda volfram kislotasi (ya'ni WO suvi)3), olingan mahsulot ammoniy paratungstatdir. 50 ° C ostida geksahidrat hosil bo'ladi, holbuki eritmaning harorati 50 ° C dan yuqori bo'lsa, pentahidrat yoki heptahidrat hosil bo'ladi. Birinchisi triklinik plitalar yoki prizmalar sifatida kristallanadi, ikkinchisi psevdorhombik ignalar shaklida. Tetrahidrat tijorat ma'noda eng muhim hisoblanadi. Shuningdek ma'lum:
- dekahidrat[6]
- nohidrat
Adabiyotlar
- ^ a b d'Amour, Xedvig; Allmann, Rudolf (1972). "Die Kristallstruktur des Ammoniumparawolframat-tetrahidratlar (NH4) 10 [H2W12O42] · 4H2O". Zeitschrift für Kristallographie. 136 (1–2): 23–47. Bibcode:1972ZK .... 136 ... 23D. doi:10.1524 / zkri.1972.136.1-2.23.
- ^ a b Lassner, Erik; Shubert, Bo'ri-Diter; Lyuderits, Eberxard; Bo'ri, Xans Uve. "Volfram, volfram qotishmalari va volfram birikmalari". Ullmannning Sanoat kimyosi ensiklopediyasi. Vaynxaym: Vili-VCH. doi:10.1002 / 14356007.a27_229.
- ^ D. J. Jons, "Sinterlash volfram va molibdenning amaliy jihatlari" (bu erda havola qilinganidek) Anorganik kimyo, J. C. Bailar Jr. va boshq., P. 744, jild 3, 1973 yil 1-nashr)
- ^ Greenwood va Earnshaw, Elementlar kimyosi, 2-nashr. 1997, 1012-1014 betlar
- ^ J. V. Mellor: Anorganik va nazariy kimyo, vol. XI, p. 812–813, Longmans Green & Co. 1931 yil
- ^ Allmann, R. (1971). "Die Struktur des Ammoniumparawolframates (NH4) 10 [H2W12O42] .10H2O". Acta Crystallographica bo'limi B. 27 (7): 1393–1404. doi:10.1107 / S0567740871004047.
