Difluoroamino oltingugurt pentaflorid - Difluoroamino sulfur pentafluoride
 | |
| Ismlar | |
|---|---|
Boshqa ismlar
| |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
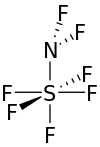
| NF 2SF 5 | |
| Molyar massa | 179.062 g / mol |
| Tashqi ko'rinishi | Rangsiz gaz |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Difluoroamino oltingugurt pentaflorid ftor, oltingugurt va azotning gazsimon kimyoviy birikmasi. Azotga bog'langan oltita-koordinatali oltingugurt atomiga ega bo'lish odatiy holdir. Ushbu moddaning boshqa nomlari kiradi difloro (pentafluorosulfur) omin, pentafluorosulfanildifluoraminva pentafluorosulfanil N,N-floramin.
Xususiyatlari
Difluoroamino oltingugurt pentaflorid xona haroratida rangsiz gazdir.[3] Molekula oltingugurt atomi atrofida tetragonal bipiramida shaklida shakllangan.[3]
Yarim daraja davomida qaynash harorati -17,5 ° S.[3]
Difluoroamino oltingugurt pentafluorid xona haroratida barqaror, ammo soat ko'rsatkichlari bo'yicha 80 ° C da parchalanadi. Parchalanish natijalari oltingugurt tetraflorid va azotli triflorid.[3] 220 ° C dan yuqori darajada barqaror emas.[4] Suv yoki zanglamaydigan po'lat bilan barqaror.[4]
Kvartsda saqlanganda va ultrabinafsha nurlar ta'sirida u ozgina parchalanadi va kremniy bilan reaksiyaga kirishib SF hosil qiladi.4 N2F4, SF6, NF3, SO2F2, SOF4va N2O.[3]
Oltingugurt va azot o'rtasidagi bog'lanish dissotsiatsiya energiyasi 50 kkal / mol bo'lganida juda zaif.[5]
Infraqizil spektrda 885, 910 va 950 sm atrofida kuchli assimilyatsiya diapazonlari mavjud−1 ftor bilan bog'lanish tufayli. Agar 910 sm da kuchli nurlanish bo'lsa−1 lazer bilan sodir bo'ladi, hosil bo'lishi uchun molekulalar buzilishi mumkin oltingugurt dekaflorid, SF4 va N2F4. Lazerning chastotasini sozlash orqali parchalanish izotoplarni tanlab olish mumkin., Shuningdek S2F10 yaqin atrofdagi boshqa chastota bilan buzilishi mumkin.[5]
Oltingugurtga biriktirilgan ftor atomlari bir-biridan 90 ° ga yaqin tutashgan va ekvator atrofidagi to'rttasi ham azotli oltingugurt bog'lanishidan 90 ° da. Ftor atomlari tomonidan azot atomiga tushadigan burchak taxminan 98 °, oltingugurt-azot-ftor burchagi esa taxminan 111 °. Oltingugurt va to'rtta ekvatorial ftor atomlari orasidagi masofa 1,545 is ni tashkil qiladi. Eksenel ftor oltingugurtgacha bo'lgan masofa 1,556 is. Azotli oltingugurt masofasi taxminan 1,696 is. Ftor-azotli bog'lanish molekuladagi eng qisqa, 1.378 at ga teng.[1]
Tayyorgarlik
Difluoroamino oltingugurt pentafluoridi aralashmani nurlantirish orqali tayyorlangan tetraflorid dinitrogen va oltingugurt tetraflorid ultrabinafsha nurlari bilan.
- N2F4 + 2 SF4 → 2 SF5NF2.[3]
Ushbu preparat shuningdek, dinitrogen tetraflorid va aralashmasi bilan ishlaydi oltingugurt xloridi pentaflorid. Shakllanish SF ko'rinishini talab qiladi5 radikal va xlor atomlari, shuningdek azot diflorid radikal.[3]
Dentloramino oltingugurt pentafluoridi hosil qilishning yana bir usuli - dinitrogen tetraflorid va oltingugurtni isitish. Bu vaqtincha shakllanishiga olib keladi azot diflorid. Ammo hosildorlik atigi 6% atrofida bo'lib, asosan oltingugurt tetraflorid hosil bo'ladi.[3]Dinitrogen tetraflorid uchun boshqa substratlar mavjud oltingugurt dekaflorid yoki oltingugurt dioksidi yoki tiofosgen elektr razryadida.[6]
A-da toj tushishi oltingugurt geksaflorid, azot aralash oz miqdordagi difloramino oltingugurt pentaflorid hosil qiladi. Bu juda muhim, chunki yuqori voltli uskunalar ko'pincha ushbu gaz birikmasi bilan izolyatsiya qilinadi.[7]
Pentafluorosulfanilamin ftor gazi bilan reaksiyaga kirishib, difloramino oltingugurt pentafloridni hosil qiladi:[8]
- SF5NH2 + 2 F2 → SF5NF2 + 2 HF
Reaksiyalar
Difluoroamino oltingugurt pentafluoridi KrF kabi Lyuis kislotalari bilan reaksiyaga kirishadi+AsF6− SF hosil qilish uchun -31 ° C da6, Kr, NF3 va qattiq N2F+AsF6−. AsF bilan5 -196 ° C da (suyuqlik kabi) qattiq N hosil qiladi2F+AsF6−, SF6 va trans-N2F2. Shu kabi mahsulotlar xona harorati reaktsiyalaridan kelib chiqadi.[9]
Foydalanish
Kombinatsiyasidan foydalanish uchun Rossiya patenti mavjud alkenlar va raketa yoqilg'isi sifatida difloramino oltingugurt pentaflorid.[10]
Bog'liq
Tegishli moddalarga ftorimidotetrafluorosulfur F kiradi4S = NF va (SF5)2NF.[11]Uchinchi darajali omin formulasi (SF) mavjud5)3N.
Azot atomining boshqa variantli almashtirishlari SF hosil qiladi5NFCl, SF5NHF, SF5NCl2 va SF5NH2.
Adabiyotlar
- ^ a b Xase, J .; Oberxammer, X .; Zentrum, V. Zayl; Glemser, O .; Mews, R. (1971 yil 1-yanvar). "Die Molekülstraktur des Difluoramin-Schwefelpentafluorids SF5NF2" (PDF). Zeitschrift für Naturforschung A (nemis tilida). 26 (8): 1333. Bibcode:1971ZNatA..26.1333H. doi:10.1515 / zna-1971-0813.
- ^ "Pentafluorosulfanildifluoroamin". Pubchem. Olingan 23 dekabr 2015.
- ^ a b v d e f g h Logotetis, A. L.; Sauzen, G. N .; Shozda, R. J. (1963 yil fevral). "Difloramino oltingugurt Pentafloridni tayyorlash". Anorganik kimyo. 2 (1): 173–175. doi:10.1021 / ic50005a044.
- ^ a b Macintyre, Jeyn E. (1992 yil 23-iyul). Noorganik birikmalar lug'ati. CRC Press. p. 3240. ISBN 9780412301209.
- ^ a b Layman, Jon L.; Danen, Ueyn S.; Nilsson, Alan S.; Nowak, Endryu V. (1979). "Difloramino oltingugurt pentafluoridning ko'p fotonli qo'zg'alishi: yutilish va ajralishni o'rganish". Kimyoviy fizika jurnali. 71 (3): 1206. Bibcode:1979JChPh..71.1206L. doi:10.1063/1.438466.
- ^ Stump, Eugene C.; Padgett, Kalvin D.; Brey, Wallace S. (1962 yil 17-noyabr). "Difloraminosulfur Pentafloridning sintezi". Anorganik kimyo. 2 (3): 648–649. doi:10.1021 / ic50007a062.
- ^ Kazanovalar, Anne-Mari; Vial, Lourens; Koll, Izabel; Saqlovchi, Magali; Kazanovalar, Jozef; Klavreul, Regin (2012-12-06). "Yuqori bosimdagi SF6 va SF6 / N2 (10-90%) aralashmalaridagi o'zgaruvchan va doimiy korona zaryadlari ostida SF6 ning parchalanishi". Xristoforuda, Lukas G.; Olthoff, Jeyms K. (tahrir). Gazli Dielektriklar VIII. Springer Science & Business Media. 379-38 betlar. ISBN 9781461548997. Olingan 23 dekabr 2015.
- ^ Verma, R. D .; Kirchmayer, Robert L.; Shrive, Janne M. (1994-09-29). "Pentafluorosulfanil birikmalari kimyosi". Anorganik kimyo fanining yutuqlari. 41. Akademik matbuot. p. 144. ISBN 9780080578903.
- ^ Xrist, Karl O.; Uilson, Uilyam V.; Shack, Karl J.; Uilson, Richard D. (1985 yil yanvar). "Lyuis kislota difloramino birikmalarining ichki molekulyar oksidlanish-qaytarilish reaktsiyalari". Anorganik kimyo. 24 (3): 303–307. doi:10.1021 / ic00197a013.
- ^ Dolbier Jr, V. R.; Ritsar, T. V.; Angxay, S. (2002). "Energiya zichligi yuqori bo'lgan flora-organik birikmalar uchun sintez va katta ko'lamli texnologiyani ishlab chiqish". DTIC. p. 2018-04-02 121 2. Olingan 23 dekabr 2015.
- ^ O'Brayen, Brayan A.; DesMarteau, Darryl D. (1982 yil sentyabr). "Ftorimidotetrafluorosulfatning ba'zi reaktsiyalari". Ftor kimyosi jurnali. 21 (1): 34. doi:10.1016 / s0022-1139 (00) 85379-8.
