Flavin guruhi - Flavin group
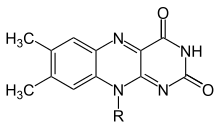

Flavin (lotin tilidan flavus, "sariq") - guruhining umumiy nomi organik birikmalar asoslangan pteridin trisiklik bilan hosil bo'lgan heterosikl izoalloksazin. Biokimyoviy manba vitamin hisoblanadi riboflavin. Flavin qism ko'pincha an bilan biriktiriladi adenozin difosfat shakllantirmoq flavin adenin dinukleotidi (FAD), va boshqa holatlarda quyidagicha topiladi flavin mononukleotidi (yoki FMN), a fosforillangan shakli riboflavin. Aynan shu shakllarning birida yoki boshqasida flavin a shaklida bo'ladi protez guruhi yilda flavoproteinlar.
Flavin guruhi o'tishga qodir oksidlanish-qaytarilish reaktsiyalari va ikkalasini ham qabul qilishi mumkin elektron ikki bosqichli jarayonda yoki bir vaqtning o'zida ikkita elektron. Reduksiya qo'shilishi bilan amalga oshiriladi vodorod atomlarning aniqligi azot atomlari izoalloksazin halqa tizimi:

Yilda suvli eritma, flavinalar oksidlanganda sariq rangga ega bo'lib, yarim kamaytirilgan anion holatida qizil rang yoki neytralda ko'k rangga ega bo'ladi (semikvinon ) holati va umuman kamayganda rangsiz.[1] Oksidlangan va kamaytirilgan shakllar tez muvozanat yarim seminon bilan (radikal ) radikal shakllanishiga qarshi shakl:[2]
- Flho'kiz + FlqizilH2 ⇌ FlH•
qaerda Flho'kiz oksidlangan flavin, FlqizilH2 kamaytirilgan flavin (ikkita vodorod atomini qo'shganda) va FlH• semikvinon shakli (bitta vodorod atomining qo'shilishi).
FADH shaklida2, bu elektronlarni ga o'tkaza oladigan kofaktorlardan biridir elektron uzatish zanjiri.
Fotosuratga olish
Ham erkin, ham oqsil bilan bog'langan flavinalar fotoreducible, ya'ni tomonidan kamaytirilishi mumkin yorug'lik, ba'zi birlari kabi bir nechta organik birikmalar vositachiligidagi mexanizmda aminokislotalar, karbon kislotalari va ominlar.[2] Flavinlarning bu xususiyati har xil nurga sezgir oqsillar tomonidan ekspluatatsiya qilinadi. Masalan, o'simlik, zamburug'lar va bakteriyalarning ko'plab turlarida uchraydigan LOV domeni qaytadigan, nurga bog'liq strukturaviy o'zgarishga uchraydi, bu uning peptidlar ketma-ketligidagi sistein qoldig'i va bog'langan FMN o'rtasida bog'lanish hosil bo'lishini o'z ichiga oladi.[3]
FAD

Flavin adenin dinukleotidi ko'plab fermentlar bilan bog'langan guruhdir, shu jumladan ferredoksin-NADP + reduktaza, monoamin oksidaz, D-aminokislota oksidaza, glyukoza oksidaz, ksantin oksidaza va asil CoA dehidrogenaza.
FADH / FADH2
FADH va FADH2 bor kamaytirilgan FAD shakllari. FADH2 protez guruhi sifatida ishlab chiqariladi süksinat dehidrogenaza, ishtirok etgan ferment limon kislotasining aylanishi. Yilda oksidlovchi fosforillanish, FADH ning ikkita molekulasi2 odatda 1,5 hosil beradi ATP har biri yoki uchta ATP birlashtirilgan.
FMN
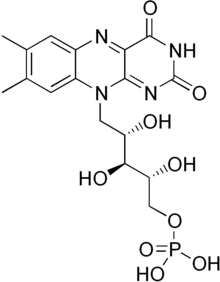
Flavin mononukleotidi a protez guruhi boshqa oqsillar qatorida, NADH dehidrogenaza, E.coli nitroreduktaza va eski sariq ferment.
Shuningdek qarang
- Pteridin
- Pterin
- Deazaflavin (5-deazaflavin)
Adabiyotlar
- ^ Mayklis L, Shubert deputati, Smit The CV (1936). "Flavinalarni potentsiometrik o'rganish". Biologik kimyo jurnali. 116 (2): 587–607.
- ^ a b Massey V, Stankovich M, Hemmerich P (yanvar 1978). "Flavoproteinlarning katalizator sifatida flavinlar bilan nurlanish vositasida kamayishi". Biokimyo. 17 (1): 1–8. doi:10.1021 / bi00594a001. PMID 618535.
- ^ Alexandre MT, Domratcheva T, Bonetti C, van Wilderen LJ, van Grondelle R, Groot ML, Hellingwerf KJ, Kennis JT (2009 yil iyul). "Ultrafast o'rta infraqizil spektroskopiya va kvant kimyosi bilan o'rganilgan fototropin LOV2 domenining birlamchi reaktsiyalari". Biofizika jurnali. 97 (1): 227–37. doi:10.1016 / j.bpj.2009.01.066. PMC 2711383. PMID 19580760.
Qo'shimcha o'qish
- Voet D, Voet JG (2004). Biokimyo (3-nashr). John Wiley & Sons. ISBN 0-471-39223-5.
