Orbital gibridizatsiya - Orbital hybridisation - Wikipedia
Yilda kimyo, orbital gibridizatsiya (yoki duragaylash) aralashtirish tushunchasi atom orbitallari yangisiga gibrid orbitallar elektronlarning hosil bo'lishiga mos keladigan (atom atomlari orbitallariga qaraganda har xil energiya, shakl va boshqalar bilan) kimyoviy aloqalar yilda valentlik aloqalari nazariyasi. Masalan, to'rtta yagona bog'lanishni hosil qiluvchi uglerod atomida valentlik qobig'i s orbital uchta valentlik qobiq p orbital bilan birikib to'rtta teng sp hosil bo'ladi.3 ichida joylashgan aralashmalar tetraedral to'rt xil atom bilan bog'lanish uchun uglerod atrofida joylashish. Gibrid orbitallar tushuntirishda foydalidir molekulyar geometriya va atom bog'lash xususiyatlari va kosmosda nosimmetrik joylashtirilgan. Odatda gibrid orbitallar taqqoslanadigan energiyalarning atom orbitallarini aralashtirish natijasida hosil bo'ladi.[1]
Tarix va foydalanish
Kimyoviy Linus Poling oddiyning tuzilishini tushuntirish uchun birinchi marta gibridizatsiya nazariyasini 1931 yilda ishlab chiqqan molekulalar kabi metan (CH4) foydalanish atom orbitallari.[2] Poling ta'kidlaganidek, uglerod atomi bitta s va uchta p orbitallardan foydalangan holda to'rtta bog'lanishni hosil qiladi, shuning uchun uglerod atomi uchta rishtani to'g'ri burchak ostida (p orbitallar yordamida) va to'rtinchi kuchsiz bog'lanishni s ba'zi bir o'zboshimchalik yo'nalishi bo'yicha orbital. Aslida metan to'rtta teng quvvatli C-H bog'lanishiga ega. Har qanday ikkita bog'lanish orasidagi burchak tetraedral bog'lanish burchagi 109 ° 28 'dan [3] (taxminan 109,5 °). Poling to'rtta vodorod atomlari mavjud bo'lganda s va p orbitallar to'rtta teng kombinatsiyani hosil qiladi deb o'ylagan gibrid orbitallar. Har bir gibrid sp bilan belgilanadi3 uning tarkibini ko'rsatish uchun va to'rtta C-H bog'lanishidan biri bo'yicha yo'naltiriladi.[4] Ushbu kontseptsiya bunday sodda kimyoviy tizimlar uchun ishlab chiqilgan, ammo keyinchalik bu yondashuv yanada kengroq qo'llanilgan va bugungi kunda u samarali hisoblanadi evristik tuzilmalarini ratsionalizatsiya qilish uchun organik birikmalar. Bu oddiy orbital rasmga teng keladi Lyuis tuzilmalari.
Gibridizatsiya nazariyasi uning ajralmas qismidir organik kimyo, bu eng ishonchli misollardan biri Bolduin qoidalari. Reaksiya mexanizmlarini chizish uchun ba'zan ikkita elektronni bo'lishadigan ikkita atomga ega bo'lgan klassik bog'lanish surati kerak bo'ladi.[5] Gibridlanish nazariyasi alkenlarda bog'lanishni tushuntiradi[6] va metan.[7] Asosan orbital duragaylash orqali hal qilinadigan p belgi yoki s belgi miqdori kislotalik yoki asoslilik kabi molekulyar xususiyatlarni ishonchli bashorat qilish uchun ishlatilishi mumkin.[8]
Umumiy nuqtai
Orbitallar - bu molekulalar ichidagi elektronlar xatti-harakatining namunaviy namoyishi. Oddiy duragaylashda bu yaqinlashishga asoslanadi atom orbitallari, vodorod atomi uchun olinganlarga o'xshash, uchun yagona neytral atom Shredinger tenglamasi aniq hal qilinishi mumkin. Kattaroq atomlarda, masalan, uglerod, azot va kislorodda, atomik orbitallar vodorod uchun qo'zg'aladigan holat orbitallariga o'xshash 2s va 2p orbitallardan foydalaniladi.
Gibrid orbitallar bir-biriga turli xil nisbatlarda joylashtirilgan atom orbitallarining aralashmalari deb qabul qilinadi. Masalan, ichida metan, har birini hosil qiladigan S gibrid orbital uglerod –vodorod Bog'lanish 25% s va 75% p belgilaridan iborat va shuning uchun sp deb ta'riflanadi3 (o'qing s-p-uch) gibridlangan. Kvant mexanikasi bu duragayni sp deb ta'riflaydi3 to'lqin funktsiyasi N (s +) shaklidagi √3pσ), bu erda N a normalizatsiya doimiysi (bu erda 1/2) va pσ - a hosil qilish uchun C-H o'qi bo'ylab yo'naltirilgan p orbital sigma aloqasi. Koeffitsientlarning nisbati (umuman λ bilan belgilanadi) √3 ushbu misolda. Beri elektron zichligi orbital bilan bog'langan to'lqin funktsiyasi kvadratiga mutanosib, p-belgining s-belgiga nisbati λ2 = 3. p belgisi yoki p komponentining vazni N ga teng2λ2 = 3/4.
Gibridizatsiya turlari
sp3

Gibridizatsiya atomlar bog'lanishini atom nuqtai nazaridan tavsiflaydi. Tetraedral koordinatali uglerod uchun (masalan, metan CH4), uglerod 4 vodorod atomiga bog'lanish uchun to'g'ri simmetriyaga ega 4 orbitalga ega bo'lishi kerak.
Uglerodniki asosiy holat konfiguratsiya 1s2 2s2 2p2 yoki osonroq o'qing:
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1s | 2s | 2p | 2p | 2p |
Uglerod atomi bitta ikkita egallagan p tipidagi orbitalidan ikkitasini hosil qilishi mumkin kovalent aloqalar singletni beradigan ikkita vodorod atomiga ega metilen CH2, eng sodda karbin. Shuningdek, uglerod atomi to'rtta vodorod atomlari bilan elektronni qo'zg'atishi (yoki ko'tarilishi) bilan ikki marta ishg'ol qilingan 2s orbitaldan bo'sh 2p orbitalga bog'lanib, to'rtta bitta egallagan orbitallarni hosil qilishi mumkin.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | 2s | 2p | 2p | 2p |
Ikkita qo'shimcha bog'lanishni hosil qilish natijasida chiqarilgan energiya talab qilinadigan qo'zg'alish energiyasini qoplaydi va to'rtta C-H bog'lanishini baquvvat ravishda qo'llab-quvvatlaydi.
Kvant mexanik ravishda, eng past energiya to'rtta bog'lanish teng bo'lsa, olinadi, bu ularning ugleroddagi ekvivalent orbitallaridan hosil bo'lishini talab qiladi. Valentlik qobig'ining chiziqli birikmasi bo'lgan to'rtta ekvivalent orbitallar to'plamini olish mumkin (yadro orbitallari bog'lanishda deyarli qatnashmaydi) s va p to'lqin funktsiyalari,[9] bu to'rtta sp3 duragaylar.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp3 | sp3 | sp3 | sp3 |
CHda4, to'rt sp3 gibrid orbitallar ustma-ust tushadi vodorod 1s orbitallar, to'rttasini beradi σ (sigma) bog'lanishlari (ya'ni to'rtta bitta kovalent bog'lanish) teng uzunlik va kuchga ega.
 ga tarjima qilinadi
ga tarjima qilinadi 
sp2


Boshqa uglerod birikmalari va boshqa molekulalarni xuddi shunday tushuntirish mumkin. Masalan, efen (C2H4) uglerodlari orasidagi juft bog'lanishga ega.
Ushbu molekula uchun uglerod sp2 duragaylar, chunki bitta π (pi) bog lanish uchun talab qilinadi qo'shaloq bog'lanish uglerodlar orasida va uglerod atomi uchun atigi uchta σ bog'lanish hosil bo'ladi. Sp2 hibridizatsiya 2s orbital mavjud bo'lgan 3p orbitallardan faqat ikkitasi bilan aralashtiriladi, odatda 2px va 2py. Uchinchi 2p orbital (2pz) gibridlanmagan bo'lib qoladi.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp2 | sp2 | sp2 | 2p |
jami uchta sp tashkil qiladi2 bitta qolgan p orbitalli orbitallar. Etilendan (efen ) ikkita uglerod atomlari bitta sp bilan to'qnashib, σ bog'lanish hosil qiladi2 har bir uglerod atomidan orbital. Molekulyar tekislikka perpendikulyar bo'lgan uglerod atomlari orasidagi π bog'lanish 2p – 2p o'zaro to'qnashuv natijasida hosil bo'ladi. Har bir uglerod atomi s-sp bo'yicha ikkita gidrogen bilan kovalent C-H bog'lanishlarini hosil qiladi2 hammasi 120 ° bog'lanish burchaklariga ega. Vodorod-uglerod aloqalari tajriba ma'lumotlariga muvofiq ravishda bir xil kuch va uzunlikka ega.
sp

Kabi birikmalardagi kimyoviy bog'lanish alkinlar bilan uch karra obligatsiyalar sp gibridizatsiyasi bilan izohlanadi. Ushbu modelda 2s orbital uchta p orbitaldan faqat bittasi bilan aralashtiriladi,
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1s | sp | sp | 2p | 2p |
natijada ikkita sp orbital va ikkita qolgan p orbitallar hosil bo'ladi. Kimyoviy birikma asetilen (etin) (C2H2) uglerod atomlari orasidagi sp-sp l bog'lash va ikkita qo'shimcha hosil qiluvchi o'zaro bog'liqlikdan iborat π obligatsiyalar p-p bir-birining ustiga chiqish bilan hosil qilingan. Har bir uglerod yana vodorod bilan 180 ° burchak ostida bir-birining ustki qismida joylashgan.
Gibridizatsiya va molekula shakli

Gibridizatsiya tushuntirishga yordam beradi molekula shakli, chunki bog'lanishlar orasidagi burchaklar taxminan gibrid orbitallar orasidagi burchaklarga teng. Bu farqli o'laroq valentlik qobig'ining elektron-juft surish (VSEPR) nazariyasi, bu molekulyar geometriyani valentlik-bog'lanish yoki orbital nazariyalariga emas, balki empirik qoidalarga asoslanib taxmin qilish uchun ishlatilishi mumkin.[10]
spx duragaylash
Ning valentlik orbitallari sifatida asosiy guruh elementlari mos keladigan bitta s va uchta p orbitallardir oktet qoidasi, spx hibridizatsiya ushbu molekulalarning shaklini modellashtirish uchun ishlatiladi.
| Muvofiqlashtirish raqami | Shakl | Gibridizatsiya | Misollar |
|---|---|---|---|
| 2 | Lineer | sp duragaylash (180 °) | CO2 |
| 3 | Uchburchak planar | sp2 duragaylash (120 °) | BCl3 |
| 4 | Tetraedral | sp3 duragaylash (109,5 °) | CCl4 |
| Interorbital burchaklar[11] | |||
spxdy duragaylash
Ning valentlik orbitallari sifatida o'tish metallari mos keladigan beshta d, bitta s va uchta p orbitallardir 18 elektron qoidasi, spxdy hibridizatsiya bu molekulalarning shaklini modellashtirish uchun ishlatiladi. Ushbu molekulalar turli xil d-orbitallar tufayli bir xil duragaylanishga mos keladigan bir nechta shaklga ega. Kvadrat planar kompleksda bitta bo'sh p-orbital mavjud va shu sababli 16 valentli elektron mavjud.[12]
| Muvofiqlashtirish raqami | Shakl | Gibridizatsiya | Misollar |
|---|---|---|---|
| 4 | Kvadrat planar | sp2d gibridizatsiya | PtCl42− |
| 5 | Trigonal bipiramidal | sp3d gibridizatsiya | Fe (CO)5 |
| Kvadrat piramidal | MnCl52− | ||
| 6 | Oktahedral | sp3d2 duragaylash | Mo (CO)6 |
| 7 | Besh qirrali bipiramidal | sp3d3 duragaylash | ZrF73− |
| Qoplangan oktahedral | Moliya vazirligi7− | ||
| Qopqoq trigonal prizmatik | TaF72− | ||
| 8 | Kvadrat antiprizmatik | sp3d4 duragaylash | ReF8− |
| Dodecahedral | Mo (CN)84− | ||
| Bikapped trigonal prizmatik | ZrF84− | ||
| 9 | Uchburchak prizmatik | sp3d5 duragaylash | ReH92− |
| Qopqoqli kvadrat antiprizmatik |
SDx duragaylash
Albatta o'tish metall past bo'lgan komplekslar d elektronlar soni, p-orbitallar bo'sh va sdx hibridizatsiya bu molekulalarning shaklini modellashtirish uchun ishlatiladi.[11][13][12]
| Muvofiqlashtirish raqami | Shakl | Gibridizatsiya | Misollar |
|---|---|---|---|
| 3 | Trigonal piramidal | SD2 duragaylash (90 °) | CrO3 |
| 4 | Tetraedral | SD3 duragaylash (70,5 °, 109,5 °) | TiCl4 |
| 5 | Kvadrat piramidal | SD4 duragaylash (65,9 °, 114,1 °) | Ta (CH3)5 |
| 6 | C3v Trigonal prizmatik | SD5 duragaylanish (63,4 °, 116,6 °) | V (CH3)6 |
| Interorbital burchaklar[11] | |||
Gipervalent molekulalarning gibridizatsiyasi
Oktetning kengayishi
Ba'zi umumiy kimyo darsliklarida gibridlanish Poling birinchi taklif qilgan d-orbitallar bilan "kengaytirilgan oktet" sxemasi yordamida asosiy guruh koordinatsion raqami 5 va undan yuqori bo'lganlar uchun berilgan. Biroq, hozirda hisoblash kimyosi hisob-kitoblari asosida bunday sxema noto'g'ri deb hisoblanadi.
| Muvofiqlashtirish raqami | Shakl | Gibridizatsiya | Misollar |
|---|---|---|---|
| 5 | Trigonal bipiramidal | sp3d gibridizatsiya | PF5 |
| 6 | Oktahedral | sp3d2 duragaylash | SF6 |
| 7 | Besh qirrali bipiramidal | sp3d3 duragaylash | IF7 |
1990 yilda Erik Alfred Magnusson Yangi Janubiy Uels universiteti d-orbital gibridizatsiyaning ikkinchi qatorning gipervalentli birikmalaridagi bog'lanishdagi rolini aniq chiqarib tashlagan (davr 3 ) nizo va chalkashliklarni tugatuvchi elementlar. Chalkashliklarning bir qismi d-funktsiyalar ushbu birikmalarni tavsiflash uchun ishlatiladigan asoslar to'plamida muhim ahamiyatga ega ekanligidan kelib chiqadi (yoki boshqa sababsiz yuqori energiya va buzilgan geometriya natijalari). Shuningdek, d-funktsiyaning molekulyar to'lqin funktsiyasiga qo'shgan hissasi katta. Ushbu faktlar d-orbitallar bog'lanishda ishtirok etishi kerak degan ma'noda noto'g'ri talqin qilingan.[14][15]
Rezonans
Nuri ostida hisoblash kimyosi, yaxshiroq davolanish ibodat qilish bo'ladi sigma aloqasi rezonans hibridizatsiyadan tashqari, bu har bir rezonans tuzilishining o'ziga xos gibridizatsiya sxemasiga ega ekanligini anglatadi. Barcha rezonans tuzilmalari oktet qoidasi.[16]
| Muvofiqlashtirish raqami | Rezonans tuzilmalari |
|---|---|
| 5 | Trigonal bipiramidal |
 | |
| 6 | Oktahedral |
 | |
| 7 | Besh qirrali bipiramidal |
 |
Izovalent gibridizatsiya
Ideal gibrid orbitallar foydali bo'lishi mumkin bo'lsa-da, aslida, ko'pgina bog'lanishlar oraliq xarakterdagi orbitallarni talab qiladi. Buning uchun har bir turdagi (s, p, d) atom orbitallarining egiluvchan og'irliklarini kiritish uchun kengaytma kerak va molekulyar geometriya ideal bog'lanish burchaklaridan chetga chiqqanda bog'lanish hosil bo'lishining miqdoriy tasvirlanishi mumkin. P-belgi miqdori butun sonlar bilan chegaralanmaydi; ya'ni, sp kabi gibridizatsiya2.5 ham osonlik bilan tavsiflanadi.
Bog'lanish orbitallarining gibridlanishi quyidagicha aniqlanadi Bent qoidasi: "Atom xarakteri elektropozitiv substituentlarga yo'naltirilgan orbitallarda konsentratlar".
Yolg'iz juftlikdagi molekulalar
Yagona juft bo'lgan molekulalar uchun bog'lovchi orbitallar izovalent spx duragaylar. Masalan, suvdagi kislorodning ikkita bog'lanish hosil qiluvchi gibrid orbitallarini sp4.0 104,5 ° interorbital burchakni berish.[17] Bu shuni anglatadiki, ular 20% s va 80% p belgilarga ega va qiladi emas gibrid orbital kisloroddagi bitta s va to'rt p orbitallardan hosil bo'lganligini nazarda tutadi, chunki kislorodning 2p pastki qobig'i faqat uchta p orbitalni o'z ichiga oladi. Yagona juftlikdagi molekulalarning shakllari:
- Trigonal piramidal
- Uch izovalent bog'lanish duragaylari (> 90 °)
- Masalan, NH3
- Egilgan
- Ikki izovalent bog'lanish duragaylari (> 90 °)
- Masalan, SO2, H2O
Bunday hollarda, yolg'iz juftlarni ifodalashning ikkita matematik jihatdan teng usuli mavjud. Ular molekulyar orbital nazariyaga o'xshash sigma va pi simmetriyasining orbitallari yoki VSEPR nazariyasiga o'xshash ekvivalent orbitallar bilan ifodalanishi mumkin.
Gipervalentli molekulalar
Yagona juft bo'lgan gipervalentli molekulalar uchun bog'lanish sxemasini gipervalentli komponentga va izovalent sp dan tashkil topgan qismga bo'lish mumkin.x bog'lanish duragaylari. Giperalvalent komponent p orbitallar yordamida rezonansli bog'lanishlardan iborat. Quyidagi jadvalda har bir shaklning ikkita komponent bilan qanday bog'liqligi va ularning tavsiflari ko'rsatilgan.
| Izovalent bog'lanish duragaylari soni (qizil bilan belgilangan) | ||||
|---|---|---|---|---|
| Ikki | Bittasi | – | ||
| Gipervalent komponent[16] | Lineer o'q (bitta p orbital) | Ko'rish | T shaklida | Lineer |
 |  |  | ||
| Kvadrat planar ekvator (ikkita p orbital) | Kvadrat piramidal | Kvadrat planar | ||
 | 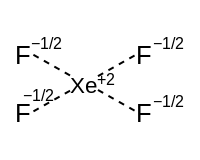 | |||
| Besh burchakli planar ekvator (ikkita p orbital) | Besh burchakli piramidal | Beshburchak planar | ||
 |  | |||
Gibridlanish nuqsonlari
S va p orbitallarini gibridizatsiyasi samarali sp hosil qiladix duragaylar ularning taqqoslanadigan lamel darajaga ega bo'lishini talab qiladi. 2p orbitallar o'rtacha 2s dan 10% dan kam kattaroq bo'lsa, qisman 2p orbitallarda radial tugun yo'qligi bilan bog'liq, bitta radial tugunga ega bo'lgan 3p orbitallar 3s orbitallardan 20-33% ga oshadi.[18] S va p orbitallarining farqi bir guruhga qarab yanada oshadi. Atomlarning kimyoviy bog'lanishdagi gibridlanishini lokalizatsiya qilingan molekulyar orbitallarni ko'rib chiqish orqali tahlil qilish mumkin, masalan, a tabiiy bog'lanish orbital (NBO) sxemasi. Yilda metan, CH4, hisoblangan p / s nisbati "ideal" sp bilan taxminan 3 ga to'g'ri keladi3 hibridizatsiya, holbuki silan, SiH4, p / s nisbati 2 ga yaqin. Boshqa 2p elementlar uchun ham shunga o'xshash tendentsiya kuzatiladi. Ftorni vodorod bilan almashtirish p / s nisbatini yanada pasaytiradi.[19] 2p elementlar ortogonal gibrid orbitallar bilan ideal gibridlanishni namoyish etadi. Og'irroq p blok elementlari uchun bu ortogonallikni taxmin qilish mumkin emas. Ideal duragaylanishdan bu og'ishlarni hibridizatsiya nuqsonlari deb atashgan Kutzelnigg.[20]
Fotoelektron spektrlar
Orbital duragaylash to'g'risidagi noto'g'ri tushunchalardan biri shundaki, u noto'g'ri bashorat qiladi ultrabinafsha fotoelektron spektrlari ko'p molekulalardan iborat. Bu to'g'ri bo'lsa-da Kupmans teoremasi mahalliy gibridlarga nisbatan qo'llaniladi, kvant mexanikasi (bu holda ionlangan) to'lqin funktsiyasi molekulaning simmetriyasiga mos kelishini talab qiladi rezonans valentlik aloqalari nazariyasida. Masalan, metanda ionlangan holatlar (CH4+) to'rtta rezonansli tuzilishdan chiqarilishi mumkin bo'lgan elektronni to'rtta spning har biriga bog'lab qo'yishi mumkin3 orbitallar. Ushbu to'rtta strukturaning chiziqli birikmasi, tuzilmalar sonini tejash, uch marta degenerat T ga olib keladi2 davlat va A.1 davlat.[21][22] Har bir ionlangan holat va asosiy holat o'rtasidagi energiya farqi bo'ladi ionlanish energiyasi, bu eksperiment bilan kelishilgan holda ikkita qiymatni beradi.
Mahalliylashtirilgan va kanonik molekulyar orbitallar
Gibrid atom orbitallaridan hosil bo'lgan bog'lash orbitallari tegishli matematik transformatsiya orqali molekulyar orbital nazariyasining delokalizatsiya qilingan orbitallaridan hosil bo'lishi mumkin bo'lgan lokalizatsiya qilingan molekulyar orbitallar deb qaralishi mumkin. Asosiy holatdagi molekulalar uchun orbitallarning bu o'zgarishi umumiy elektron to'lqin funktsiyasini o'zgarishsiz qoldiradi. Shuning uchun asosiy holatning gibrid orbital tavsifi teng asosiy holatning umumiy energiyasi va elektron zichligi, shuningdek, minimal umumiy energiya qiymatiga mos keladigan molekulyar geometriya uchun delocalized orbital tavsifiga.
Ikki mahalliy vakolatxonalar
Ko'p bog'langan yoki bir nechta yolg'iz juftlikdagi molekulalar sigma va pi simmetriyasi yoki ularga teng keladigan orbitallar bo'yicha ifodalangan orbitallarga ega bo'lishi mumkin. Turli xil valentlik bog'lash usullari matematik jihatdan teng miqdordagi ko'p elektronga ega bo'lgan ikkita tasvirdan birini qo'llaydi to'lqin funktsiyalari va a bilan bog'liq unitar transformatsiya egallagan molekulyar orbitallar to'plamining.
Ko'plab bog'lanishlar uchun sigma-pi vakili ekvivalent orbitalga nisbatan ustunlik qiladi (egilgan bog'lanish ) vakillik. Aksincha, bir nechta yolg'iz juftliklar uchun aksariyat darsliklar ekvivalent orbital tasvirdan foydalanadi. Shu bilan birga, sigma-pi vakili, masalan, Weinhold va Landis tomonidan ishlatilgan tabiiy bog'lanish orbitallari, klassik (valentlik aloqasi / Lyuis tuzilishi) bog'lovchi juftlik va yolg'iz juftlikning modernizatsiya qilingan analoglarini o'z ichiga olgan lokalizatsiya qilingan orbital nazariya.[23] Masalan, ftorli vodorod molekulasi uchun ikkita F yolg'iz juftligi asosan gibridlanmagan p orbital, ikkinchisi esa spx gibrid orbital. Shu kabi mulohaza suvga taalluqlidir (bitta O juftlik sof p orbitalda, ikkinchisi spdax gibrid orbital).
Shuningdek qarang
- Kristal maydon nazariyasi
- Izovalent gibridizatsiya
- Ligand maydon nazariyasi
- Atom orbitallarining chiziqli birikmasi
- MO diagrammalari
Adabiyotlar
- ^ Housecroft, Ketrin E.; Sharpe, Alan G. (2005). Anorganik kimyo (2-nashr). Pearson Prentice-Hal. p. 100. ISBN 0130-39913-2.
- ^ Poling, L. (1931), "Kimyoviy bog'lanishning tabiati. Kvant mexanikasi va molekulalarning tuzilishiga paramagnitik ta'sirchanlik nazariyasidan olingan natijalarni qo'llash", Amerika Kimyo Jamiyati jurnali, 53 (4): 1367–1400, doi:10.1021 / ja01355a027
- ^ Brittin, W. E. (1945). "Tetraedral uglerod atomining valentlik burchagi". J. Chem. Ta'lim. 22 (3): 145. Bibcode:1945JChEd..22..145B. doi:10.1021 / ed022p145.
- ^ L. Poling Kimyoviy bog'lanishning tabiati (3-nashr, Oksford universiteti matbuoti 1960) p.111–120.
- ^ Kleyden, Jonatan; Grivves, Nik; Uorren, Styuart; Xafa qiladi, Piter (2001). Organik kimyo (1-nashr). Oksford universiteti matbuoti. p. 105. ISBN 978-0-19-850346-0.
- ^ Organik kimyo, Uchinchi nashr Meri Enn Foks Jeyms K. Uaytsell 2003 ISBN 978-0-7637-3586-9
- ^ Organik kimyo 3 Ed. 2001 Paula Yurkanis Bruice ISBN 978-0-130-17858-9
- ^ "Kislotalar va asoslar". Orgo Made Simple. Olingan 23 iyun 2015.
- ^ McMurray, J. (1995). Kimyo izohli o'qituvchilari nashri (4-nashr). Prentice Hall. p. 272. ISBN 978-0-131-40221-8
- ^ Gillespi, R.J. (2004), "VSEPR modeli bilan molekulyar geometriyani o'qitish", Kimyoviy ta'lim jurnali, 81 (3): 298–304, Bibcode:2004JChEd..81..298G, doi:10.1021 / ed081p298
- ^ a b v Vaynxold, Frank; Landis, Klark R. (2005). Valency va bog'lash: Tabiiy bog'lanish orbital donor-aktseptor istiqbollari. Kembrij: Kembrij universiteti matbuoti. 367, 374-376, 381-383-betlar. ISBN 978-0-521-83128-4.
- ^ a b Beys, Kreyg; Xoll, Maykl (1999). "Simmetriya tahlili bilan oddiy o'tish metall polihidrit komplekslari geometriyasini bashorat qilish". J. Am. Kimyoviy. Soc. 121 (6): 1348–1358. doi:10.1021 / ja981965 +.
- ^ Kaupp, Martin (2001). ""VSEPRga tegishli bo'lmagan "d (0) tizimdagi tuzilmalar va bog'lash". Angew Chem Int Ed Engl. 40 (1): 3534–3565. doi:10.1002 / 1521-3773 (20011001) 40:19 <3534 :: AID-ANIE3534> 3.0.CO; 2- #. PMID 11592184.
- ^ Magnusson, E. (1990). "Ikkinchi qator elementlarining giperkoordinatali molekulalari: d funktsiyalarmi yoki d orbitallarmi?". J. Am. Kimyoviy. Soc. 112 (22): 7940–7951. doi:10.1021 / ja00178a014.
- ^ Devid L. Kuper; Terri P. Kanningem; Jozef Gerratt; Piter B. Karadakov; Mario Raymondi (1994). "Ikkinchi qator atomlarini giperkoordinat bilan kimyoviy bog'lash: d orbital ishtirok va demokratiya". Amerika Kimyo Jamiyati jurnali. 116 (10): 4414–4426. doi:10.1021 / ja00089a033.
- ^ a b Richard D. Xarkurt; Tomas M. Klapotke (2003). "Ftor o'z ichiga olgan elektronlarga boy molekulalarning elektron tuzilmalarining valentligi (sifatli valentlik aloqasi) tavsifining ortishi". Ftor kimyosi jurnali. 123 (1): 5–20. doi:10.1016 / S0022-1139 (03) 00012-5.
- ^ Frenking, Gernot; Shaik, Sason, nashr. (2014). "3-bob: Kimyoviy bog'lash to'g'risida NBOning ko'rinishi". Kimyoviy bog'lanish: kimyoviy bog'lashning asosiy jihatlari. John Wiley & Sons. ISBN 978-3-527-66471-9.
- ^ Kaupp, Martin (2007). "Kimyoviy bog'lanish uchun atom orbitallarining radiusli tugunlarining roli va davriy tizim". Hisoblash kimyosi jurnali. 28 (1): 320–325. doi:10.1002 / jcc.20522. ISSN 0192-8651. PMID 17143872. S2CID 12677737.
- ^ Kaupp, Martin (2014) [1-chi. Pub. 2014]. "1-bob: Asosiy guruh elementlarini kimyoviy bog'lash". Frenking, Gernod va Shaik, Sason (tahr.). Kimyoviy bog'lanish: davriy jadval bo'yicha kimyoviy bog'lash. Vili-VCH. ISBN 978-1-234-56789-7.
- ^ Kutzelnigg, W. (1988 yil avgust). "Ortogonal va ortogonal bo'lmagan duragaylar". Molekulyar tuzilish jurnali: THEOCHEM. 169: 403–419. doi:10.1016/0166-1280(88)80273-2.
- ^ Andrey M. Tokmachev; Andrey L. Tsugreyff; Igor A. Misurkin (2001). "Qat'iy lokalizatsiya qilingan ayollarga xos yarim semirlik antisimmetrizlangan mahsulot tarkibidagi ionlanish potentsiali". Xalqaro kvant kimyosi jurnali. 85 (3): 109–117. doi:10.1002 / kv.1060.
- ^ Sason S. Shaik; Phillipe C. Hiberty (2008). Valens majburiyatlari nazariyasi bo'yicha kimyogar uchun qo'llanma. Nyu-Jersi: Vili-Interersxn. 104-106 betlar. ISBN 978-0-470-03735-5.
- ^ Vaynxold, Frank; Landis, Klark R. (2012). Tabiiy bog'langan orbitallar bilan kimyo kashfiyoti. Xoboken, NJ: Uili. 67-68 betlar. ISBN 978-1-118-11996-9.


