Adenilosuksinat liaza - Adenylosuccinate lyase
| Adenilosuksinat liaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
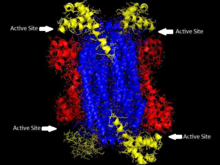 ASL ning homotetramerik tuzilishi Thermotoga maritima 1-domen qizil rangda, 2-domen ko'k rangda, 3-domen sariq rangda. Ushbu tuzilma Toth va Yeates tomonidan yozilgan qog'ozdan ilhomlangan[5] | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 4.3.2.2 | ||||||||
| CAS raqami | 9027-81-0 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Adenilosuksinat liaza (yoki adenilosuksinaza) an ferment odamlarda ADSL tomonidan kodlanganligi gen.[6]
Adenilosuktsinat liaza konvertatsiya qiladi adenilosuksinat ga AMP va fumarate qismi sifatida purin nukleotid tsikli. ASL purin biosintez yo'lidagi ikkita reaktsiyani katalizlaydi, bu AMP hosil qiladi; ASL adenilosuktsinatni AMP va fumarate va yoriqlar SAICAR ichiga AICAR va fumarat.
Adenilosuktsinat liaza bu qismga kiradi β-yo'q qilish superfamily fermentlar va u an orqali davom etadi E1cb reaktsiya mexanizmi. Ferment a homotetramer har birida uchta domen mavjud monomer va to'rtta faol saytlar homotetramer uchun.
Nuqta mutatsiyalar pasayishiga olib keladigan adenilosuktsinatda fermentativ faollik holatni belgilaydigan klinik simptomlarni keltirib chiqaradi adenilosuksinat liaza etishmovchiligi.
Ushbu oqsil morfeyn modeli allosterik regulyatsiya.[7]
Funktsiya

Adenilosuktsinat liaza (ASL) - tarkibidagi ikkita reaktsiyani katalizlovchi ferment de novo purin biosintezi yo'l. Ikkala reaktsiyada ham E1cb yo'q qilish reaktsiyasi fumaratni substratdan ajratish mexanizmi. Birinchi reaktsiyada ASL 5-aminoimidazol- (N-süksinilokarboksamid) ribotidni (SAICAR) 5-aminoimidazol-4-karboksamid ribotid (AICAR) va fumaratga aylantiradi. AICAR adenilosuktsinat bo'lishidan oldin yana uchta reaktsiyadan o'tib (suktsiniladenozin monofosfat yoki SAMP deb ham ataladi), ASL keyinchalik adenozin monofosfat (AMP) va fumaratga bo'linadi.[8] ASL hujayralar uchun nafaqat uning uchun zarur bo'lgan purinlarni yaratishda ishtirok etishi bilan muhimdir uyali replikatsiya, shuningdek, bu hujayradagi AMP va fumarat darajasini boshqarish orqali metabolik jarayonlarni tartibga solishga yordam beradi.[9]

Tuzilishi
Subbirliklar
Adenilosuktsinat liaza b-eliminatsiya superfamilasiga kiradi va shuning uchun uning tuzilishi homotetramerdir. Adenilosuksinat liaza monomeri uchta domenga ega. Yilda Thermotoga maritima, 1-domen 7 ni o'z ichiga oladi a-spirallar yilda qoldiqlar 1-93, shu jumladan His68 juda konservalangan va ilgari katalitik deb hisoblangan kislota ichida faol sayt.[5] Yaqinda o'tkazilgan tadqiqotlar His171 domen 2-da, ilgari katalitik deb o'ylagan tayanch, aslida hech bo'lmaganda katalitik kislota vazifasini bajarishi mumkin Escherichia coli.[9] 2-domen 94-341 qoldiqlaridan tashkil topgan bo'lib, tarkibida 5 a-spiral va monomerning yagona b-varaq. 3-domen 7 a-spiraldan iborat. Tetramerning yadrosi to'rtta domen 2 nusxadan iborat bo'lib, tetramerning har ikki uchida 1 va 3 domenlarning ikkitasi bor, ular tetramer D2 ni beradi. dihedral simmetriya. Tetramerda to'rtta faol sayt mavjud bo'lib, ularning har birida uchta domenlar uchrashadi.[5]
Odamlarda adenilosuksinat liaza va Bacillus subtilis bolishi mumkin raqobatbardosh ravishda taqiqlangan tomonidan analog substrat adenozin fosfonobutirik kislota 2 ’(3’), 5’-difosfat (APBADP). APBADP adenilosuktsinat liaza tomonidan katalizlanadigan ikkala reaktsiya uchun ham raqobatdosh inhibitordir va kinetik tadqiqotlar APBADP yordamida ikkala reaktsiya uchun substratlar bir xil faol joydan foydalanilishini ko'rsatadi.[10] ASL-katalizlangan reaktsiyada adenilosuktsinatni adenozin monofosfat (AMP) va fumaratga ajratish jarayonida AMP reaksiya tugagandan so'ng va fumarat chiqmasdan oldin bir oz aylanib turishi kerak, chunki har ikkala mahsulot ham faol maydonga tushishi kerak.[11]
Mutatsiyalar
Adenilosuksinat liaza mutantlar mutatsiya faol joyda yoki undan tashqarida bo'lishidan qat'i nazar, faollikni sezilarli darajada kamaytirishi mumkin. Kasallik keltirib chiqaradigan ASL mutantlari R396C va R396H faol uchastkaning kirish qismida joylashgan bo'lib, undan pastroq Vmaksimal yovvoyi tipdagi ASL ga qaraganda, lekin faol joydan uzoqda bo'lgan K246E va L311V mutantlari ham V ning pasayishiga olib keladimaksimal. ASL mutant R194C faol saytdan uzoqda va u V ni saqlaydimaksimal yovvoyi tipdagi ASLga o'xshash, beshta mutantning konformatsion jihatdan eng past barqarorligi ko'rsatilgan in vitro va hali ham kasallik keltirib chiqaradi.[12]
Mexanizm
Adenilosuktsinat liaza uchun harakat mexanizmi kelishilgan kataliz bo'lib, u erda ugleroddagi vodorod (chiqadigan azotga nisbatan) katalitik asos bilan ajralib chiqadigan azotning protonatsiyalanishi bilan ajralib chiqadi. E2 eliminatsiyasi uchun katalitik kislota.[5] Yaqinda olingan ma'lumotlar ushbu g'oyaga zid keladi va mexanizm aslida kelishilmaganligini, lekin abstraktsiya birinchi bo'lib sodir bo'lganligini va oraliq mavjudligini tasdiqladi karbanion rezonans stabillashadigan turlar. ASL-katalizlangan har ikkala reaktsiya uchun avval uglerodning ajralib chiqqan azotga deprotonatsiyasi sodir bo'ladi, so'ngra hosil bo'lishi va rezonansni barqarorlashtirish karbanion paydo bo'ladi va oxir-oqibat tarkibi azotning protonatsiyasi, bu esa C-N bog'lanishining uzilishiga olib keladi.[9] Deprotonatsiya, karbanion hosil bo'lishi va protonatsiyaning tezlikni cheklash bosqichini sinchkovlik bilan tasdiqlash, bu parchalanishga olib keladi, bu E1cb mexanizmi. So'nggi ma'lumotlarga ko'ra, katalitik kislota His171 bo'lib, u ilgari katalitik asos deb hisoblangan va u g'ayritabiiy ravishda 295 pozitsiyasida serin bo'lib, katalitik asos bo'lib xizmat qiladi. Adenilosuktsinatning AMP va fumarat bilan parchalanishi tartiblangan bir-bi mexanizm bo'lib, demak, fumarat AMP dan oldin faol joydan chiqib ketadi.[13]

Kasallikdagi roli
Mutatsiyaga uchragan adenilosuktsinat liaza (ASL) deb ataladigan bemorlarda klinik kasallikka sabab bo'ladi adenilosuksinat liaza etishmovchiligi. Bu holat kamdan-kam uchraydi va u turli darajalarda namoyon bo'ladi psixomotor sustkashlik, autizm, mushaklarning ozishi va epilepsiya.[14][15] Kasallikning aniq sababi noma'lum, ammo imkoniyatlar etarli emas purin nukleotid uchun sintez hujayraning replikatsiyasi, noto'g'ri ishlash purin nukleotid tsikli va substratlarning toksik darajaga ko'tarilishi. Bir nechta kasallik bilan bog'liq nuqta mutatsiyalari aniqlandi va ular heterozigot chunki mutatsion sog'lom, ammo ular sog'lom bir jinsli klinik kasallikni rivojlantiradi.[16] Kasalliklarni keltirib chiqaradigan genotiplar soni mutatsiyalar aniqlanganda tobora ko'payib bormoqda va hozirda o'ttiz xil nuqtali mutatsiyalar aniqlandi va adenilosuktsinat liaza etishmovchiligini keltirib chiqaradigan bitta o'chirish.[17]
ASL (adenilosucinat va SAICAR) substratlari ferment etishmovchiligi tufayli hosil bo'lganda, ular deposforillangan va süksiniladenozin (S-Ado) va süksinilaminoimidazol karboksimid ribozid (SAICA ribosid) ga aylanadi.[18] Odatda bu birikmalar miya omurilik suyuqligi yoki siydikda mavjud emas, chunki ASL substrat molekulalarining ko'pchiligida tuzilib, fosforillanishidan oldin ishlaydi.[15] Ilgari adenilosuktsinat liaza etishmovchiligi bo'yicha yaxshi sinov o'tkazilmagan va kam uchraydigan kasallikni aniqlash qiyin bo'lgan, ammo yaqinda siydikda SAICA va S-Adoni aniqlash uchun test ishlab chiqilgan. Sinov arzon va tadqiqotchilarning kichik namunalarida noto'g'ri ijobiy yoki noto'g'ri salbiy bo'lmagan.[19]
SAICA ribozidi yanada toksik birikma bo'lishi mumkin deb o'ylashadi, chunki u og'ir klinik alomatlari bo'lgan bemorlarda yuqori darajada uchraydi va ba'zi tadqiqotchilar S-Ado hatto himoya bo'lishi mumkin deb o'ylashadi. Kasallikning zo'ravonligini aniqlaydigan narsa haqida ko'proq tadqiqotlar o'tkazish kerak, ammo laboratoriya sharoitida insonning ASL-ning beqarorligi ushbu tadqiqotga to'siq bo'ldi.[17]
Terapevtik dasturlar
Bezgakka qarshi qarshilik kuchayishi bilan tadqiqotchilar maqsadga qaratilgan yangi strategiyalarni izlamoqdalar Plazmodium sabab bo'lgan parazitlar bezgak, ayniqsa ko'proq o'limga olib keladi P. falciparum. Ba'zi tadqiqotchilar ASLni potentsial giyohvand moddasi sifatida ko'rib chiqishni taklif qilishdi, chunki uning to'xtatilishi de novo purin biosintezi yo'l egasi uchun toksik, Plazmodium ASL ning past darajasi bor ketma-ketlik gomologiyasi har qanday qarshi ta'sir ko'rsatishi mumkin bo'lgan inson ASL bilanPlazmodium ASL preparatlari inson xostlariga zarar etkazmaslik uchun etarli darajada aniq.[20]
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000239900 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000022407 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ a b v d e Toth EA, Yeates TO (fevral 2000). "De novo purin biosintezi yo'lida ikki tomonlama faollikka ega ferment - adenilosuktsinat liaza tuzilishi". Tuzilishi. 8 (2): 163–74. doi:10.1016 / S0969-2126 (00) 00092-7. PMID 10673438.
- ^ "Entrez Gen: Adenilosuksinat liaza". Olingan 2012-03-01.
- ^ Selwood T, Jaffe EK (2012 yil mart). "Dinamik dissotsilanuvchi homo-oligomerlar va oqsillar faoliyatini boshqarish". Biokimyo va biofizika arxivlari. 519 (2): 131–43. doi:10.1016 / j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ Spiegel EK, Colman RF, Patterson D (2006). "Adenilosuksinat liaza etishmovchiligi". Molekulyar genetika va metabolizm. 89 (1–2): 19–31. doi:10.1016 / j.ymgme.2006.04.018. PMID 16839792.
- ^ a b v d Tsai M, Koo J, Yip P, Colman RF, Segall ML, Howell PL (iyul 2007). "Escherichia coli adenylosuccinate liase substrat va mahsulot komplekslari fermentativ mexanizm haqida yangi tushunchalar beradi". Molekulyar biologiya jurnali. 370 (3): 541–54. doi:10.1016 / j.jmb.2007.04.052. PMC 4113493. PMID 17531264.
- ^ Sivendran S, Colman RF (Iyul 2008). "Yangi bo'linmaydigan substrat analogining Bacillus subtilis va Homo sapiens adenilosuktsinat liazasining imzo qatoridagi yovvoyi va serin mutantlarga ta'siri". Proteinli fan. 17 (7): 1162–74. doi:10.1110 / ps.034777.108. PMC 2442012. PMID 18469177.
- ^ Kozlov G, Nguyen L, Pearsall J, Gehring K (sentyabr 2009). "Fosfat bilan bog'langan Escherichia coli adenylosuccinate liase tuzilishi His171 ni katalitik kislota deb biladi". Acta Crystallographica bo'limi F. 65 (Pt 9): 857-61. doi:10.1107 / S1744309109029674. PMC 2795585. PMID 19724117.
- ^ Ariyananda Lde Z, Li P, Antonopulos S, Colman RF (iyun 2009). "Kasallik bilan bog'liq bo'lgan beshta adenilosuktsinat liaza mutantlarining biokimyoviy va biofizik tahlili". Biokimyo. 48 (23): 5291–302. doi:10.1021 / bi802321m. PMC 2745324. PMID 19405474.
- ^ Bulusu V, Srinivasan B, Bopanna MP, Balaram H (2009 yil aprel). "Plazmodium falciparum dan adenilosuktsinat liaza substratining o'ziga xosligini, kinetik va katalitik mexanizmini aniqlash". Biochimica et Biofhysica Acta (BBA) - Oqsillar va Proteomikalar. 1794 (4): 642–54. doi:10.1016 / j.bbapap.2008.11.021. PMID 19111634.
- ^ Maaswinkel-Mooij PD, Laan LA, Onkenhout V, Brouwer OF, Jaeken J, Poorthuis BJ (Avgust 1997). "Erta chaqaloqlik davrida epilepsiya bilan kechadigan adenilosuksinaza etishmovchiligi". Irsiy metabolik kasallik jurnali. 20 (4): 606–7. doi:10.1023 / A: 1005323512982. PMID 9266401.
- ^ a b Li P, Colman RF (2007 yil fevral). "Odamning barqaror, rekombinant adenilosuktsinat liazasini ifodalash, tozalash va tavsiflash". Proteinlarni ifoda etish va tozalash. 51 (2): 227–34. doi:10.1016 / j.pep.2006.07.023. PMID 16973378.
- ^ Stone RL, Aimi J, Barshop BA, Jeken J, Van den Berghe G, Zalkin H, Dikson JE (1992 yil aprel). "Adenilosuktsinat liazadagi aqliy qoloqlik va autistik xususiyatlar bilan bog'liq mutatsiya". Tabiat genetikasi. 1 (1): 59–63. doi:10.1038 / ng0492-59. PMID 1302001.
- ^ a b Palenchar JB, Crocco JM, Colman RF (Avgust 2003). "Mutant Mutant Bacillus subtilis adenilosuktsinat liazalarining odam adenilosuktsinat liazasi etishmovchiligiga mos keladigan tavsifi". Proteinli fan. 12 (8): 1694–705. doi:10.1110 / ps.0303903. PMC 2323956. PMID 12876319.
- ^ Jeken J, Van den Berghe G (1984 yil noyabr). "Tana suyuqliklarida süksinilpurinlar mavjudligi bilan tavsiflangan infantil autistik sindrom". Lanset. 2 (8411): 1058–61. doi:10.1016 / s0140-6736 (84) 91505-8. PMID 6150139.
- ^ Maddocks J, Rid T (Yanvar 1989). "Autistik bolalarda adenilosuktsinaza etishmovchiligi uchun siydik tekshiruvi". Lanset. 1 (8630): 158–9. doi:10.1016 / S0140-6736 (89) 91172-0. PMID 2563072.
- ^ Marshall VM, Coppel RL (1997 yil sentyabr). "Plazmodium falciparum adenilosuktsinat liazasini kodlovchi genning xarakteristikasi". Molekulyar va biokimyoviy parazitologiya. 88 (1–2): 237–41. doi:10.1016 / S0166-6851 (97) 00054-6. PMID 9274883.
Qo'shimcha o'qish
- Mari S, Cuppens H, Heuterspreute M, Jaspers M, Tola EZ, Gu XX, Legius E, Vinsent MF, Jaeken J, Cassiman JJ, Van den Berghe G (1999). "Adenilosuksinat liaza etishmovchiligidagi mutatsion tahlil: qayta ko'rib chiqilgan to'liq ADSL kodlash ketma-ketligidagi sakkizta yangi mutatsiyalar". Inson mutatsiyasi. 13 (3): 197–202. doi:10.1002 / (SICI) 1098-1004 (1999) 13: 3 <197 :: AID-HUMU3> 3.0.CO; 2-D. PMID 10090474.
- Kmoch S, Hartmannová H, Stibrková B, Krijt J, Zikánová M, Sebesta I (iyun 2000). "Odam adenilosuktsinat liazasi (ADSL), klonlash va to'liq uzunlikdagi cDNA xarakteristikasi va uning izoformasi, gen tuzilishi va olti bemorda ADSL etishmovchiligining molekulyar asoslari". Inson molekulyar genetikasi. 9 (10): 1501–13. doi:10.1093 / hmg / 9.10.1501. PMID 10888601.
- Race V, Mari S, Vinsent MF, Van den Berghe G (2000 yil sentyabr). "Adenilosuktsinat liaza etishmovchiligidagi klinik, biokimyoviy va molekulyar genetik korrelyatsiyalar". Inson molekulyar genetikasi. 9 (14): 2159–65. doi:10.1093 / hmg / 9.14.2159. PMID 10958654.
- Tabucchi A, Carlucci F, Rosi F, Guerranti R, Marinello E (iyun 2001). "Qon hujayralarida adenilosuktsinat liazani aniqlash, faolligi va biologik roli". Biomeditsina va farmakoterapiya. 55 (5): 277–83. doi:10.1016 / s0753-3322 (01) 00061-0. PMID 11428554.
- Mari S, Race V, Nassogne MC, Vinsent MF, Van den Berghe G (Iyul 2002). "Adenil suktsinat liaza etishmovchiligi bo'lgan uchta bemorda ADSL genining 5 'tarjima qilinmagan mintaqasida yadroli nafas olish omil-2 bog'lanish joyining mutatsiyasi". Amerika inson genetikasi jurnali. 71 (1): 14–21. doi:10.1086/341036. PMC 384970. PMID 12016589.
- Kastro M, Peres-Cerda S, Merinero B, Gartsiya MJ, Bernar J, Gil Nagel A, Torres J, Bermudes M, Garavito P, Mari S, Vinsent F, Van den Berge G, Ugarte M (Avgust 2002). "Adenilosuktsinat liaza etishmovchiligini skrining qilish: to'rtta bemorda klinik, biokimyoviy va molekulyar topilmalar". Neyropediatriya. 33 (4): 186–9. doi:10.1055 / s-2002-34493. PMID 12368987.
- Palenchar JB, Colman RF (2003 yil fevral). "Mutant mutasaddi Bacillus subtilis adenylosuccinate liase-ning inson adenilosuktsinat liaza etishmovchiligida uchraydigan mutant fermentiga ekvivalenti: asparagin 276 muhim tarkibiy rol o'ynaydi". Biokimyo. 42 (7): 1831–41. doi:10.1021 / bi020640 +. PMID 12590570.
- Edery P, Chabrier S, Ceballos-Picot I, Mari S, Vinsent MF, Tardieu M (Iyul 2003). "Adenilosuktsinat liaza etishmovchiligining fenotipik ifodasidagi intrafamilial o'zgaruvchanlik: uchta bemor haqida hisobot". Amerika tibbiyot genetikasi jurnali A qism. 120A (2): 185–90. doi:10.1002 / ajmg.a.20176. PMID 12833398.
- Stone RL, Aimi J, Barshop BA, Jeken J, Van den Berghe G, Zalkin H, Dikson JE (1992 yil aprel). "Adenilosuktsinat liazadagi aqliy qoloqlik va autistik xususiyatlar bilan bog'liq mutatsiya". Tabiat genetikasi. 1 (1): 59–63. doi:10.1038 / ng0492-59. PMID 1302001.
- Sivendran S, Patterson D, Spiegel E, McGown I, Cowley D, Colman RF (Dekabr 2004). "Autizm va ekvivalent mutant Bacillus subtilis ASL ning xarakteristikasi bilan bog'liq bo'lgan ikkita yangi mutant odam adenilosuksinat liazalari". Biologik kimyo jurnali. 279 (51): 53789–97. doi:10.1074 / jbc.M409974200. PMID 15471876.
Tashqi havolalar
- Adenilosuksinat + liaza AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
- Inson ADSL genom joylashuvi va ADSL gen tafsilotlari sahifasida UCSC Genome brauzeri.
- Inson ASL genom joylashuvi va ASL gen tafsilotlari sahifasida UCSC Genome brauzeri.




