Alanin racemase - Alanine racemase
| alanin rasemazasi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Alanin rasemazasining 1,45ase kristalli tuzilishi Pseudomonas aeruginosa, PDB 1rcq | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 5.1.1.1 | ||||||||
| CAS raqami | 9024-06-0 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
| Ala_racemase_N | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 1.45Å patogen bakteriya - pseudomonas aeruginosa dan alanin rasemazasining kristalli tuzilishi ichki va tashqi aldimin shakllarini o'z ichiga oladi | |||||||||
| Identifikatorlar | |||||||||
| Belgilar | Ala_racemase_N | ||||||||
| Pfam | PF01168 | ||||||||
| Pfam klan | CL0036 | ||||||||
| InterPro | IPR001608 | ||||||||
| PROSITE | PDOC00332 | ||||||||
| SCOP2 | 1sft / QOIDA / SUPFAM | ||||||||
| |||||||||
| Ala_racemase_C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| Belgilar | Ala_racemase_C | ||||||||
| Pfam | PF00842 | ||||||||
| InterPro | IPR011079 | ||||||||
| PROSITE | PDOC00332 | ||||||||
| SCOP2 | 1sft / QOIDA / SUPFAM | ||||||||
| |||||||||
Yilda enzimologiya, an alanin rasemazasi (EC 5.1.1.1 ) an ferment bu kataliz qiladi The kimyoviy reaktsiya
- L-alanin D-alanin
Demak, bu ferment bitta fermentga ega substrat, L-alanin va bitta mahsulot, D-alanin.
Ushbu ferment. Oilasiga tegishli izomerazalar, aniqrog'i o'sha racemases va epimerazlar harakat qilish aminokislotalar va hosilalar. The sistematik ism bu fermentlar sinfiga kiradi alanin rasemazasi. Ushbu ferment ham deyiladi L-alanin rasemazasi. Ushbu ferment ishtirok etadi alanin va aspartat metabolizm va D-alanin metabolizm. U bitta ishlaydi kofaktor, piridoksal fosfat. Kamida ikkita birikma, 3-Ftor-D-alanin va D-sikloserin ma'lum ushbu fermentni inhibe qiling.
Alanin rasemazasi tomonidan ishlab chiqarilgan D-alanin peptidoglikan biosintezi uchun ishlatiladi. Peptidoglikan barcha bakteriyalar, shu jumladan odam uchun zararli bo'lgan hujayralar devorlarida uchraydi. Ferment yuqori eukaryotlarda yo'q, ammo prokaryotlarda hamma joyda uchraydi, bu esa alanin rasemazasini antimikrobiyal dori ishlab chiqarish uchun ajoyib maqsadga aylantiradi.[1] Alanin rasemazasi ba'zi umurtqasiz hayvonlarda uchraydi.[2]
Bakteriyalar bitta (alr gen) yoki ikkita alanin rasemaza geniga ega bo'lishi mumkin. Alanin rasemazasi uchun ikkita genga ega bakteriyalar turlarining biri doimiy ravishda ifodalanadigan va biri induktiv bo'lib, bu giyohvand moddalarni o'rganish uchun ikkala genni ham nishonga olishni qiyinlashtiradi. Biroq, nokaut tadqiqotlari shuni ko'rsatdiki, alr geni ifoda etilmasdan, bakteriyalar omon qolish uchun tashqi D-alanin manbasiga muhtoj. Shuning uchun alr geni antimikrobiyal dorilar uchun mumkin bo'lgan maqsaddir.[1]
Strukturaviy tadqiqotlar
D va L alaninning o'zaro ta'sirini kataliz qilish uchun Alanin rasemazasi alaninning alfa uglerodining har ikki tomonida protonlarni almashtiradigan qoldiqlarni joylashtirishi kerak. Ferment-inhibitör komplekslarini tizimli tadqiqotlar shuni ko'rsatadiki, tirozin 265 va lizin 39 bu qoldiqlardir. L-enantiomerning alfa-protoni Tyr265 ga, D-enantiomerning alfa-protoni Lys39 ga yo'naltirilgan (1-rasm).
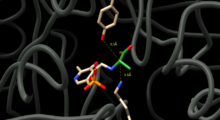
Ferment qoldiqlari va enantiomerlar orasidagi masofa mos ravishda 3,5A va 3,6A ga teng.[3] Sintetik L-alanin analogi, mahkam bog'lovchi inhibitori bilan fermentlar komplekslarini tizimli tadqiq qilish [4] va propionat [5] Tyr265 va Lys39 reaktsiyaning katalitik asoslari ekanligini yanada tasdiqlang.[4][6]
PLP-L-Ala va PLP-D-Ala komplekslari deyarli bir xilda.[3] Qatlamaydigan joylar PLP ning piridin halqasi va alaninning alfa uglerodiga bog'langan qo'llardir. Fosfat kislorod va piridin azot atomlarining PLP-Alaning 5'fosfopiridoksil mintaqasi bilan o'zaro ta'siri, ehtimol ferment bilan qattiq bog'lanishni hosil qiladi.[3]

Alanin rasemazasining tuzilishi Bacillus stearothermophilus (Geobacillus stearothermophilus) tomonidan aniqlandi Rentgenologik kristallografiya 1,9 A piksellar soniga[6] Alanin rasemazasi monomer ikkita domendan, N terminalidagi sakkizta torli alfa / beta bochkadan va asosan beta-zanjirdan tashkil topgan C-terminal domendan iborat. Ikkala domen strukturasining modeli 2-rasmda keltirilgan. N-terminal domeni shuningdek PROSC (proline) da joylashgan sintetaza birgalikda yozilgan bakterial homolog) alanin rasemaza faolligi borligi ma'lum bo'lmagan oqsillar oilasi. The piridoksal 5'-fosfat (PLP) kofaktor alfa / beta bochkasining og'zida va yuqorida joylashgan va shunday kovalent ravishda a bilan alduminiy aloqasi orqali bog'langan lizin qoldiq, bu alfa / beta bochkaning birinchi beta-zanjirining C uchida.
Tavsiya etilgan mexanizm
Reaksiya mexanizmlarini tajriba bilan to'liq isbotlash qiyin. Alanin rasemaza reaktsiyasiga kiritilgan an'anaviy mexanizm bu PLP stabillashgan karbanion qidiruv vositasi bo'lgan ikki asosli mexanizmdir. PLP, alfa uglerodning deprotonatsiyasi natijasida kelib chiqadigan salbiy zaryadni barqarorlashtiradigan elektron lavabo sifatida ishlatiladi. Ikkala asosli mexanizm bitta asosiy mexanizmga nisbatan reaktsiyaning o'ziga xosligini ma'qullaydi. Ikkinchi katalitik qoldiq karbanionli oraliq hosil bo'lgandan keyin protonni tezda berish uchun oldindan joylashtirilgan va shu bilan alternativ reaktsiyalar paydo bo'lish ehtimolini kamaytiradi. Vatanabe va boshqalar tomonidan belgilab qo'yilganidek, ushbu an'anaviy mexanizm bilan ikkita potentsial to'qnashuv mavjud. Birinchidan, Arg219 PLP ning piridin azoti bilan vodorod bog'lanishini hosil qiladi.[6] Arginin guruhi taxminan 12,6 pKa ga ega va shuning uchun piridinni protonlashi mumkin emas. Odatda PLP reaktsiyalarida karbon kislotasi guruhi kabi kislotali aminokislota qoldig'i, pKa taxminan 5 ga teng, piridin halqasini protonlaydi.[7] Piridin azotining protonatsiyasi azotning qo'shimcha salbiy zaryad olishiga imkon beradi. Shuning uchun Arg219 tufayli PLP stabillashgan karbanion qidiruv moddasi hosil bo'lish ehtimoli kam. Lys39 va Tyr265 ni protonli va protonlanmagan shakllariga qaytarib L-alanin uchun, aksincha D-alanin uchun yana bir asosiy qoldiqqa ehtiyoj bor edi. Vatanabe va boshq. PLP-Ala karboksilat guruhidan tashqari aminokislota qoldiqlari yoki suv molekulalari Lys yoki Tirni protonlashi yoki deprotonatlashi uchun etarli darajada (4,5A ichida) topilmadi. Bu 3-rasmda ko'rsatilgan.[3]

N- (5’-fosfopiridoksil) L- alanin (PKP-L-Ala (va N- (5’-fosfopiridoksil) D-alanin (PLP-D-Ala)) ning kristalli tuzilmalari asosida.
Vatanabe va boshq. 4-rasmda ko'rinib turganidek, 2002 yilda muqobil mexanizmni taklif qildi. Ushbu mexanizmda PLP-Ala-ning karboksilat kislorod atomlari to'g'ridan-to'g'ri Lys39 va Tyr265 oralig'idagi protonlarni uzatishda katalizda ishtirok etadi. Kristallanish tuzilishi PLP-L-Ala ning TH265 ning OH ga karboksilat kislorodining atigi 3.6A ekanligini va PLP-L-Ala ning Lys39 azotiga karboksilat kislorodining atigi 3.5A ekanligini aniqladi. Shuning uchun, ikkalasi ham reaktsiyaga sabab bo'ladigan darajada yaqin edi.

Ushbu mexanizmni Arg219 mutatsiyalari qo'llab-quvvatlaydi. Arg219-ni karboksilatga o'zgartiradigan mutatsiyalar xinonoid oraliq moddasini aniqlanishiga olib keladi, ammo arginin bilan aniqlanmagan.[8] Arginin qidiruvi kislota qoldig'i mutantlariga qaraganda ancha erkin energiyaga ega, beqaror.[7] Qidiruv mahsulotning beqarorlashishi reaktsiyaning o'ziga xosligini ta'minlaydi.[8][9]
Adabiyotlar
- ^ a b Milligan Daniel L.; va boshq. (2007). "Mycobacterium smegmatis ning Alaninli rasemazasi D-Alanin yo'qligida o'sish uchun muhimdir". Bakteriologiya jurnali. 189 (22): 8381–8386. doi:10.1128 / jb.01201-07. PMC 2168708. PMID 17827284.
- ^ Abe, H; Yoshikava, N; Sarower, M. G.; Okada, S (2005). "Suvdagi hayvonlarda erkin D-alaninning fiziologik funktsiyasi va metabolizmi". Biologik va farmatsevtika byulleteni. 28 (9): 1571–7. doi:10.1248 / bpb.28.1571. PMID 16141518.
- ^ a b v d Watanabe, A., Yoshimura, T., Mikami, B., Hayashi, H., Kagamiyama, H., Esaki, N. (2002) Alanin rasemazasining Bacillus stearothermophilus dan reaktsiya mexanizmi: bog'langan fermentning rentgen-kristallografik tadqiqotlari. ichida - (5'-fosfopiridoksil) alanin Biologik kimyo jurnali 277, 19166-19172.
- ^ a b Stamper, G. F., Morollo, A. A. va Ringe, D. (1998) Biokimyo 37,10438 –10445
- ^ Morollo, A. A., Petsko, G. A. va Ringe, D. (1999) Biokimyo 38, 3293-3301
- ^ a b v Shou, J. P., Petsko, G. A. va Ringe, D. (1997) 1.9-A rezolyusiya bo'yicha biokimyo 36, 1329-1342 da Bacillus stearothermophilus dan Alanine racemase tuzilishini aniqlash.
- ^ a b Toney, Maykl D. (2004) Piridoksal fosfat fermentlarida reaktsiyaning o'ziga xos xususiyati, Biokimyo va biofizika arxivlari 433, 279-287.
- ^ a b Sun S., Toney, MD (1998) Arginin-219 dan Alanin Rassemaz Mutantlari Tirozin-265 ni o'z ichiga olgan ikki asosli mexanizm uchun dalillar 38, 4058-4065
- ^ Rubinshteyn, A., Major, D. T. (2010) Argininning 210 kvant mexanik molekulyar mexanik simulyatsiyalaridan Alanin ratsemazidagi katalitik o'ziga xoslikni tushunish 210 Mutant Biokimyo 49, 3957-3963.
Qo'shimcha o'qish
- MARR AG, UILSON PW (1954). "Brucella abortusning alaninli rasemazasi". Arch. Biokimyo. Biofiz. 49 (2): 424–33. doi:10.1016/0003-9861(54)90211-8. PMID 13159289.
- Wood WA (1955). "Aminokislota rasemazalari". Enzimol usullari. Enzimologiyadagi usullar. 2: 212–217. doi:10.1016 / S0076-6879 (55) 02189-7. ISBN 9780121818029.
- Yog'och WA, GUNSALUS IC (1951). "D-Alanin hosil bo'lishi; Streptococcus faecalis-da rasemaza". J. Biol. Kimyoviy. 190 (1): 403–16. PMID 14841188.

