Arsenat - Arsenate
| |||
| Ismlar | |||
|---|---|---|---|
| IUPAC nomi zirhli | |||
| Identifikatorlar | |||
3D model (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
CompTox boshqaruv paneli (EPA) | |||
| |||
| |||
| Xususiyatlari | |||
| AsO3− 4 | |||
| Molyar massa | 138.919 | ||
| Konjugat kislotasi | Arsenik kislotasi | ||
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |||
| Infobox ma'lumotnomalari | |||
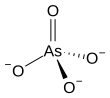
The arsenat ion bu SifatidaO3−
4.An arsenat (birikma) har qanday birikma tarkibida ushbu ion mavjud. Arsenatlar tuzlar yoki Esterlar ning mishyak kislotasi.Arsenatdagi mishyak atomi a ga ega valentlik ning 5 va shuningdek, sifatida tanilgan besh valentli mishyak yoki Sifatida (V).Arsenat o'xshaydi fosfat ko'p jihatdan, beri mishyak va fosfor ning bir xil guruhida (ustunida) uchraydi davriy jadval. Arsenatlar o'rtacha oksidlovchilar, an bilan elektrod potentsiali +0.56 danV ga kamaytirish uchun arsenitlar.
Hodisa
Arsenatlar tabiiy ravishda turli xil holatlarda uchraydi minerallar. Ushbu minerallar o'z ichiga olishi mumkin namlangan yoki suvsiz arsenatlar. Fosfatlardan farqli o'laroq, arsenatlar minerallardan yo'qolmaydi ob-havo. Arseniy tarkibidagi minerallarga misollar kiradi adamit, alarsit, annabergit, eritrit va legrandit.[1] Zaryadni formulada muvozanatlash uchun ikkita arsenat ioni zarur bo'lgan joyda, u deyiladi parchalanish masalan, trizinc diarsenate, Zn3(AsO4)2.
Ionlar
Arsenat so'zi kelib chiqadi mishyak kislotasi, H3AsO4. Ushbu o'rtacha kuchli kislota aylanadi dihidrogen arsenat (H
2AsO−
4), vodorod arsenati (HAsO2−
4) va arsenat (AsO3−
4pH ga qarab. Ushbu turlarning miqdoriy munosabati kislota dissotsilanish konstantalari bilan belgilanadi:
- H3AsO4 + H2O ⇌ H2AsO−
4 + H3O+ (K1 = 10−2.19) - H2AsO−
4 + H2O ⇌ HAsO2−
4 + H3O+ (K2 = 10−6.94) - HAsO2−
4 + H2O ⇌ AsO3−
4 + H3O+ (K3 = 10−11.5)
Ushbu qiymatlar vodorod fosfatlarnikiga o'xshashdir. Suvli eritmada neytral pH ga yaqin vodorod arsenati va dihidrogen arsenati ustunlik qiladi.
Arsenatdan zaharlanish
Arsenat noorganik o'rnini bosishi mumkin fosfat ning qadamida glikoliz ishlab chiqaradi 1,3-bifosfogliserat dan glitseraldegid 3-fosfat. Bu hosil beradi 1-arseno-3-fosfogliserat o'rniga, bu beqaror va tez gidrolizlanib, yo'lda keyingi oraliqni hosil qiladi, 3-fosfogliserat. Shuning uchun glikoliz davom etadi, ammo ATP hosil bo'ladigan molekula 1,3-bifosfogliserat yo'qoladi - arsenat glikolizning birlashtiruvchisi bo'lib, uning toksikligini tushuntiradi.[2]
Boshqa mishyak aralashmalari singari, arsenit ham bog'lanadi lipoik kislota,[3] konversiyasining oldini olish piruvat ichiga atsetil-KoA, blokirovka qilish Krebs tsikli va shuning uchun ATP ning yana yo'qolishiga olib keladi.[4]
Shuningdek qarang
- Turkum: Arsenatlar
Adabiyotlar
- ^ Mineralienatlas - Mineralklasse fosfat, Arsenat, Vanadat. (nemis tilida)
- ^ Xyuz, Maykl F. (2002). "Arsenik toksikligi va potentsial ta'sir mexanizmlari" (PDF). Toksikologiya xatlari (133): 4.[doimiy o'lik havola ]
- ^ "Arxivlangan nusxa". Arxivlandi asl nusxasi 2018 yil 20 martda. Olingan 4 fevral 2018.CS1 maint: nom sifatida arxivlangan nusxa (havola)
- ^ Kim Gele; Selene Chou; Uilyam S. Bekket (2009 yil 1 oktyabr), Arsenik toksikligi holatini o'rganish, Toksik moddalar va kasalliklarni ro'yxatga olish agentligi