Karbokatsiya - Carbocation



A karbokatsiya (/ˌk.rboʊˈkætaɪən/[1]) an ion musbat zaryadlangan uglerod atom. Eng oddiy misollar orasida meteniy CH+
3, metan CH+
5 va vinil C
2H+
3 kationlar. Ba'zida, bir nechta musbat zaryadlangan uglerod atomiga ega bo'lgan karbokatsiyalar ham uchraydi (masalan, etilenning tiklanishi C
2H2+
4).[2]
1970-yillarning boshlariga qadar barcha karbokatsiyalar chaqirilgan karboniy ionlari.[3] IUPAC tomonidan berilgan hozirgi ta'rifda karbokatsiya - uglerod atomiga sezilarli qisman musbat zaryadga ega bo'lgan har qanday juft elektronli kation. Ular bo'yicha ikkita asosiy toifaga ko'ra tasniflanadi muvofiqlashtirish raqami zaryadlangan uglerodning: uchta karboniy ionlari va beshta karboniy ionlari. Ushbu nomenklatura tomonidan taklif qilingan G. A. Olax.[4] Dastlab Olax tomonidan aniqlangan karboniy ionlari a bilan tavsiflanadi uch markazli ikki elektron delokalizatsiya qilingan bog'lash sxemasi va asosan "klassik bo'lmagan karbokatsiyalar ', bu C-C yoki C-H σ-bog'lanishlarini o'z ichiga olgan karbokatsiyalardir. Biroq, boshqalar "karboniy ioni" atamasini rasmiy ravishda protonlangan yoki alkillangan alkanlar (ya'ni CR5+, bu erda R - vodorod yoki alkil), 2-norboril kationi kabi klassik bo'lmagan karbokatsiyalarni chiqarib tashlash.[5]
Ta'riflar
Ga ko'ra IUPAC, a karbokatsiya elektronlarning juft sonini o'z ichiga olgan har qanday kation bo'lib, unda musbat zaryadning muhim qismi uglerod atomiga to'g'ri keladi.[6] Olax va uning hamkasblari tomonidan beshta koordinatali karbokatsiya kuzatuvidan oldin, karbokatsiya va karboniy ioni bir-birining o'rnida ishlatilgan. Olax qayta ta'riflashni taklif qildi karboniy ioni har qanday uch markazli ikki elektronli bog'lanishni o'z ichiga olgan karbokatsiya sifatida, a karbenium ioni uchta koordinatali musbat uglerodga ega bo'lgan faqat ikki markazli ikki elektronli bog'lanishlarni o'z ichiga olgan karbokatsiya haqida yangi o'ylab topilgan. Keyinchalik, boshqalar bu atamani ishlatgan karboniy ioni H ning elektrofil hujumidan kelib chiqqan (hech bo'lmaganda rasmiy ravishda) turlarga murojaat qilish uchun torroq+ yoki R+ boshqa asosiy guruhga o'xshab alkanda oniy turlari, uch karrali bog'lanishning har qanday turini o'z ichiga olgan karbokatsiya esa a deb ataladi klassik bo'lmagan karbokatsiya. Ushbu ishlatishda 2-norbornil kationi karboniy ioni emas, chunki u rasmiy ravishda alken emas, balki alken (norbornen) protonatsiyasidan olingan, garchi u ko'prikli tuzilishi tufayli klassik bo'lmagan karbokatsiya bo'lsa ham. IUPAC karboniy ionining uchta turli xil ta'riflarini tan oladi va ushbu atamani qo'llashda ehtiyot bo'lishni talab qiladi. Ushbu maqolaning qolgan qismida atama karboniy ioni bu oxirgi cheklangan ma'noda ishlatiladi, while klassik bo'lmagan karbokatsiya ko'prik yordamida delokalizatsiya qilingan C-C va / yoki C-H σ-bog'lanishlari bo'lgan har qanday karbokatsiyaga murojaat qilish uchun foydalaniladi.
1990-yillarning oxiridan boshlab aksariyat darsliklar klassik uch koordinatali karbokatsiya uchun karboniy ioni atamasidan foydalanishni to'xtatdi. Biroq, ba'zi bir universitet darajasidagi darsliklarda karbokatsiya atamasi xuddi karbenium ionining sinonimi bo'lganidek ishlatilmoqda,[7][8] yoki karbokatsiyalarni faqat karboniy ionlarining eski terminologiyasiga oid qisqa ma'lumot bilan muhokama qiling[9] yoki karbenium va karboniy ionlari.[10] Bitta darslikda karboniy ioni uchun karboniy ionining eski nomi shu kungacha saqlanib qolgan va bu ibora ishlatilgan gipervalent karboniy ioni uchun CH+
5.[11]
Gidrid ionini (H.) Rasmiy ravishda olib tashlash natijasida olingan ikki koordinatali musbat uglerodli karbokatsiya−) alkendan a nomi bilan tanilgan vinil kation. Geometrik cheklovlar bo'lmagan taqdirda, ko'pgina almashtirilgan vinil kationlari chiziqli geometriyaning sp-gidridlangan uglerod atomida rasmiy musbat zaryadga ega. Ikkala koordinatali sp2- arendan gidrid ionini rasmiy ravishda olib tashlash natijasida hosil bo'lgan gibridlangan kation an deb nomlanadi aril kation. Ushbu karbokatsiyalar nisbatan beqaror (ayniqsa, aril kationlari) va kamdan-kam uchraydi. Shuning uchun ular kirish va o'rta darajadagi darsliklardan tez-tez chiqarib tashlanadi. IUPAC ta'rifida karbokatsiyalar juft elektronlar turiga kiradi; shuning uchun CH kabi radikal kationlar4•+ mass-spektrometriyada tez-tez uchrab turadigan karbokatsiyalar hisoblanmaydi.
Tarix
Karbokatsiyalar tarixi 1891 yil G. Merlingdan boshlanadi[12] u tropilidenga brom qo'shganligi haqida xabar berdi (sikloheptatrien ) va keyin kristalli, suvda eruvchan material olish uchun mahsulotni qizdirdi, C
7H
7Br. U buning uchun tuzilishni taklif qilmadi; ammo, Doering va Noks[13] ishonchli ekanligini ko'rsatdi tropiliy (sikloheptatrieniliy) bromid. Ushbu ion bo'lishi taxmin qilinmoqda aromatik tomonidan Gyckelning qoidasi.
1902 yilda Norris va Kehrman buni mustaqil ravishda rangsiz kashf etdilar trifenilmetanol quyuq sariq rangli eritmalarni konsentrlangan holda beradi sulfat kislota. Trifenilmetil xlorid alyuminiy va qalay xloridlari bilan o'xshash shakllangan apelsin komplekslari. 1902 yilda, Adolf fon Baeyer hosil bo'lgan birikmalarning tuzga o'xshash xususiyatini tan oldi. Tritil karbokatsiya (quyida ko'rsatilgan) barqaror karbokatsion tizim sifatida organik sintezda bir hil organokatalizator sifatida ishlatilgan.[14]

U rang va tuzning hosil bo'lishi o'rtasidagi munosabatni nomladi haloxromiya, ulardan malakit yashil eng yorqin misoldir.
Karbokatsiyalar reaktiv qidiruv vositalar ko'plab organik reaktsiyalarda. Birinchi tomonidan taklif qilingan ushbu g'oya Yulius Stiglitz 1899 yilda,[15] tomonidan yanada ishlab chiqilgan Xans Meervin uning 1922 yilgi ishida[16][17] ning Vagner-Meerwein-ni qayta tashkil etish. Carbocations ham ishtirok etganligi aniqlandi SN1 reaktsiya, E1 reaktsiyasi va qayta tashkil etish reaktsiyalari kabi Whitmore 1,2 smena. Kimyoviy korxona karbokatsiya tushunchasini qabul qilishni istamadi va uzoq vaqt davomida Amerika Kimyo Jamiyati jurnali ushbu maqolalarni eslatib o'tdi.
Birinchi NMR spektri eritmadagi barqaror karbokatsiya haqida Doering va boshq.[18] 1958 yilda. Bu geptametil edibenzen ion, davolash orqali qilingan geksametilbenzol bilan metil xlorid va alyuminiy xlorid. Barqaror 7-norbornadienil kationini Story va boshq. 1960 yilda[19] reaksiya bilan norbornadienil xlorid bilan tetrafloroborat kumush yilda oltingugurt dioksidi -80 ° C darajasida. NMR spektri uning klassik bo'lmagan ko'prik ekanligini aniqladi (birinchi barqaror) klassik bo'lmagan ion kuzatilgan).
1962 yilda, Olax to'g'ridan-to'g'ri kuzatilgan tert-butil tomonidan karbokatsiya yadro magnit-rezonansi eriydigan barqaror tur sifatida tert- butil ftorid sehrli kislota. Norbornil kationining YMM haqida birinchi marta Shleyer va boshq.[20] va Sonders va boshqalar tomonidan to'siqdan proton bilan tortishuvga uchraganligi ko'rsatilgan.[21]
Tuzilishi va xususiyatlari
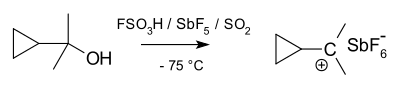
Karboniy ionlarini protonlangan alkanlar deb qarash mumkin. Alkanlar odatda inert deb hisoblansa ham, super kislotali sharoitda (masalan, HF / SbF)5), C-H sigma aloqasi H ga donor bo'lib xizmat qilishi mumkin+. Buning natijasida uglerod uchun nisbatan kam uchraydigan bo'lsa ham, uglerod va ikkita vodorod atomlari o'rtasidagi bog'lanishning bir turi bo'lgan 3c-2e bog'lanish mavjud. Muqobil nuqtai nazar sifatida karboniy ionlarining 3c-2e bog'lanishini H molekulasi deb hisoblash mumkin2 karbenium ioniga muvofiqlashtirilgan (pastga qarang). Darhaqiqat, karboniy ionlari tez-tez molekulyar vodorodni yo'qotish natijasida parchalanib, tegishli karbeniy ionini hosil qiladi. Strukturaviy ravishda metan ioni CH5+ ning minimal energiya tuzilishiga ega bo'lishi uchun hisoblab chiqilgan Cs simmetriya. Shu bilan birga, ionning turli xil mumkin bo'lgan tuzilmalari energiyaga yaqin va sayoz to'siqlar bilan ajralib turadi. Demak, ionning tuzilishi ko'pincha quyidagicha tavsiflanadi oqimli. Garchi karboniy ionlarida uglerod bilan beshta bog'lanish mavjud bo'lsa-da, ular yo'q gipervalent, markaziy uglerod atrofida elektronlar soni sakkiztani tashkil etganligi sababli, 3c-2e bog'lanish hisobiga.
Aksincha, hech bo'lmaganda rasmiy ma'noda karboniy ionlari protonatsiyadan olinadi (H qo'shilishi+) yoki alkillanish (R qo'shilishi+) ning karbin yoki alken. Shunday qilib, ularning kamida bittasida rezonans tasvirlar, ular elektron seksteti bilan o'ralgan (oltita) rasmiy musbat zaryadga ega bo'lgan uglerod atomiga ega valentlik elektronlari ) uglerodning valentlik qobig'ini to'ldirish uchun zarur bo'lgan odatiy oktet o'rniga (oktet qoidasi ). Shuning uchun karbenium ionlari (va umuman karbokatsiyalar) ko'pincha reaktiv bo'lib, valentlik elektronlari oktetasini to'ldirishga va neytrallikni qaytarishga intiladi. zaryadlash. Ga muvofiq VSEPR va Bent qoidasi, agar piramidal (masalan, 1-odamantil kationi) bo'lishi uchun geometrik jihatdan cheklanmagan bo'lsa, 3-koordinatali karbenium ionlari odatda trigonal planar bo'lib, sof p belgi bo'sh orbital bo'lib, uning egasi bo'lmagan eng past molekulyar orbital (LUMO) va CH / CC bog'lanishlari C dan hosil bo'ladi. (sp2) orbitallar. Prototipik misol metil kationidir, CH+
3. Xuddi shu sabablarga ko'ra, 2-koordinatali (vinil kationlar) karbokatsiyalar odatda geometriyada chiziqli bo'lib, CH / CC bog'lanishlari C (sp) orbitallaridan hosil bo'ladi.

Alkil bilan almashtirilgan karbokatsiyalar barqarorlikda 3 °> 2 °> 1 °> metil tartibiga amal qiladi, chunki gidrid ionlarining yaqinlik qiymatlari (231, 246, 273 va 312 kkal / mol (CH uchun)3)3C+, (CH3)2CH+, C2H5+va CH3+).[22] Alkilni almashtirishning ta'siri kuchli: uchinchi darajali kationlar barqaror va ko'plari bevosita kuzatiladi superatsid muhit, ammo ikkilamchi kationlar odatda vaqtinchalik va faqat izopropil, s-butil va siklopentil kationlari eritmada kuzatilgan.[23] Eritma fazasida birlamchi karbokatsiyalarni eksperimental qo'llab-quvvatlash kamdan-kam hollarda bo'ladi, hattoki vaqtinchalik qidiruv moddalar (99,9% sulfat kislota va FSO reaktsiyalari uchun etil kation taklif qilingan)2OH-SbF5),[24] va metil kation faqat gaz fazasida aniq aniqlangan. Ko'pgina hollarda, agar hammasi bo'lmasa ham, da'vo qilingan birlamchi karbokatsiyalarning asosiy holati ko'prikli tuzilmalardan iborat bo'lib, ularda musbat zaryad ikki yoki undan ortiq uglerod atomlari bilan taqsimlanadi va ular yon protonlangan alkenlar, chekka protonlangan siklopropanlar yoki burchak protonli sifatida yaxshiroq tavsiflanadi. haqiqiy kationlardan ko'ra siklopropanlar.[25][26] Hatto oddiy etil kationi ham C2H5+, ko'prikli ekanligi eksperimental va hisoblash yo'li bilan namoyish etilgan va uni nosimmetrik protonlangan etilen molekulasi deb hisoblash mumkin. Xuddi shu narsa 1-propil va 1-butil kationlari kabi yuqori gomologlar uchun ham amal qiladi.[27] Neopentil hosilalari metil guruhining bir vaqtda ko'chishi bilan ionlashadi deb o'ylashadi (ankimerik yordam ); Shunday qilib, aksariyat hollarda, aksariyat hollarda, diskret neopentil kation ishtirok etmaydi.[28]
Alkil guruhlari tomonidan stabillashish bilan izohlanadi giperkonjugatsiya. Density C-H yoki C-C bog'lanishidan karbokatsionning bo'sh p orbitaliga (a σ) elektron zichligi ehsoniCH / CC → p o'zaro ta'sir) ijobiy zaryadni delokalizatsiya qilishga imkon beradi.
Gidrid ionlari yaqinligiga asoslanib, ota-vinil kation hatto birlamchi spga qaraganda kamroq barqaror2-gibridlangan karbokatsiya, a alkil bilan almashtirilgan vinil kation esa oxirgisi bilan taqqoslanadigan barqarorlikka ega. Demak, vinil kationlari nisbatan kam uchraydigan oraliq moddalardir. Chiqish guruhi etarlicha yaxshi bo'lgan taqdirda, ular vinil elektrofilning ionlashishi natijasida hosil bo'lishi mumkin (masalan, TfO–, IPh yoki N2). Ular ba'zi vinil almashtirish reaktsiyalarida oraliq moddalar sifatida ishtirok etishgan (S deb belgilanganN1 (vinil)) va arilalkinlarning elektrofil qo'shilish reaktsiyalarida oraliq moddalar sifatida. Ko'pikli tur deb hisoblanadigan ota-ona vinil kationidan tashqari va geometrik jihatdan cheklangan tsiklik vinil kationlaridan tashqari, ko'pchilik vinil kationlar sp-gibridlanishni oladi va chiziqli bo'ladi.
Aryl kationlari vinil kationlarga qaraganda beqarorroq, chunki ular chiziqli bo'lmagan geometriya va taxminan sp2- band bo'lmagan orbitalning xarakteristikasi. Faqat N2 arildiazonium tuzlarida, aril kationlarining kimyoviy hosil bo'lishi uchun etarlicha yaxshi guruhdir.
Alkinil kationlari nihoyatda beqaror, hatto CH ga qaraganda ancha kam barqaror3+ (gidrid ionlarining yaqinligi 386 kkal / mol va CH uchun 312 kkal / mol3+) va faqat kimyoviy vositalar yordamida hosil bo'lmaydi. Biroq, ular radiokimyoviy usulda beta-parchalanish ning tritiy: (RC≡CT → [RC≡C3U]+ + e– + νe → RC≡C+ + 3U + e– + νe).[29]

Reaktivlik nuqtai nazaridan karbokatsiyalar hujumga moyil nukleofillar, suv, spirtlar, karboksilatlar, azid va galogenid ionlari singari qo'shimcha mahsulot hosil qilish uchun. Kuchli asosli nukleofillar, ayniqsa to'sqinlik qiladiganlar, qo'shilishdan ko'ra yo'q qilishni afzal ko'rishadi. Zaif nukleofillar ham karbokatsiya bilan reaksiyaga kirishganligi sababli, ularning aksariyati faqat to'g'ridan-to'g'ri nukleofil bo'lmagan muhitda kuzatilishi yoki ajratilishi mumkin. super kislotalar.

Karbokatsiyalar odatda o'tadi qayta tashkil etish reaktsiyalari alkil guruhi yoki vodorodning kationli markazga yangi karbokatsion markazni hosil qilish uchun ko'chishi bilan unchalik barqaror bo'lmagan tuzilmalardan bir xil darajada barqaror yoki barqarorroqqa. Bu ko'pincha bilan sodir bo'ladi stavka konstantalari 10 dan ortiq10 s−1 atrof-muhit haroratida va hali ham tezda (NMR vaqt o'lchovi bilan taqqoslaganda) –120 ° C gacha bo'lgan haroratda (qarang Vagner-Meerwein smenasi ). 2-norboril kationi kabi ayniqsa qulay holatlarda, vodorod siljishlari 86 K (-187 ° C) da rentgen kristallografiyasiga xalaqit beradigan darajada tez sur'atlar bilan sodir bo'lishi mumkin.[30] Odatda, karbokatsiyalar uchinchi darajali izomerni berish uchun qayta tashkil etiladi. Masalan, C ning barcha izomerlari6H11+ 1-metil-1-siklopentil kationini berish uchun tezda qayta tuzing. Bu haqiqat ko'pincha sintetik yo'llarni murakkablashtiradi. Masalan, 3-pentanol suvli HCl bilan qizdirilganda, dastlab hosil bo'lgan 3-pentil karbokatsiya 3-pentil va 2-pentilning statistik aralashmasiga qayta tuziladi. Ushbu kationlar xlorid ioni bilan reaksiyaga kirishib, taxminan hosil qiladi1⁄3 3-xloropentan va2⁄3 2-xloropentan. Ushbu cheklovdan Fridel-Kraft alkilatsiyasi aziyat chekadi; shuning uchun tez-tez asilatsiya (keyinchalik alkillangan mahsulotni berish uchun Volf-Kishner yoki Klemmensen reduksiyasi) qo'llaniladi.
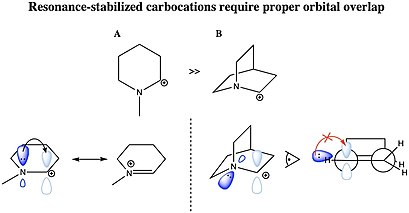
Karbokatsiya stabillashishi mumkin rezonans uglerod-uglerodli er-xotin bog'lanish yoki yakka a juftlik bilan heteroatom ionlashgan uglerodga qo'shni. Karbokatsiya rezonansi barqarorlashishi uchun molekulyar orbital xayr-ehson guruhining karbokatsiyaning bo'sh 2p orbitaliga ta'sir o'tkazish uchun tegishli simmetriya, yo'nalish va energiya darajasiga ega bo'lishi kerak. Bunday kationlar allil kation CH2= CH – CH2+ va benzil kation C6H5–CH2+ density tizimlardan katyonik markazga elektron zichligi ehson qilinganligi sababli boshqa karbokatsiyalarga qaraganda ancha barqaror. Bundan tashqari, karbokatsiyalar aromatik molekulalar asosan stabillashadi, asosan aromatik halqalarga xos bo'lgan delokalizatsiyalangan especially elektronlari tufayli.[31] Alil yoki benzil karbokatsiya hosil qilishi mumkin bo'lgan molekulalar ayniqsa reaktivdir. C bo'lgan bu karbokatsiyalar+ ikki yoki uch marta bog'langan boshqa uglerod atomiga qo'shni bo'lib, karbokatsiyaning bo'sh p orbitalining p bog'lanishining p orbitallari bilan qoplanishi sababli qo'shimcha barqarorlikka ega. Orbitallarning bir-birining ustiga chiqib ketishi musbat zaryadning tarqalishiga va allows tizimidagi elektron zichligini elektron etishmaydigan markaz bilan bo'lishishiga imkon beradi, natijada stabillashadi. Ikki va uch karra benzil karbokatsiyalar, difenilkarboniy va trifenilkarboniy (tritil) kationi, ayniqsa barqaror. Xuddi shu sabablarga ko'ra siklopropil guruhlaridagi kuchlanishli C-C bog'lanishlarining qisman p xususiyati ham elektron zichligini berishga imkon beradi va siklopropilmetil (siklopropilkarbinil) kationi.
Karbokatsiyalarning barqarorlik darajasi, eng barqarordan eng barqarorgacha, gidrid ionlarining yaqinligi (HIA) qiymatlarida aks ettirilgan, quyidagicha (QIA qavatlardagi kkal / moldagi qiymatlar):
| Karbokatsiya | c-v7H7+ (eng barqaror) | (C6H5)3C+ | c-v3H3+ | (C6H5)2CH+ | 2-norbornil+ | t-C4H9+ | C6H5CH2+ | iso-C3H7+ |
| HIA (kkal / mol) | 201 | 215 | 221 | 222 | 231 | 231 | 234 | 246 |
| Karbokatsiya | c-v3H5CH2+ | CH2= CH – CH2+ | c-v5H5+ | CH≡C – CH2+ | C2H5+ | C2H3+ | C6H5+ | CH3+ (kamida barqaror) |
| HIA (kkal / mol) | 249 | 256 | 258 | 270 | 273 | 287 | 298 | 312 |
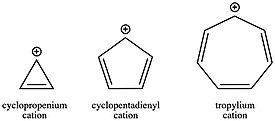
Tarix bo'limida ta'kidlanganidek tropiliy kationi (C7H7+) tufayli topilgan birinchi karbokatsiyalardan biri edi aromatik barqarorlik. Tropiliy karbokatsiyasi shu qadar barqarorlashganki, molekulani ajratib olish va tuz sifatida sotish mumkin. Boshqa tomondan, aromatik qarshi siklopentadienil kationi (C5H5+) taxminan 40 kkal / mol bilan beqarorlashadi. Siklopropenium kationi (C3H3+), burchak zo'riqishi bilan biroz beqarorlashgan bo'lsa-da, uning ochiq zanjirli analog, allil kationi bilan taqqoslaganda aromatiklik bilan aniq barqarorlashadi. Ushbu o'zgaruvchan kation turg'unliklari, halqa tizimidagi elektronlar soniga qarab, reaktsiya kinetikasida hal qiluvchi omil bo'lishi mumkin. Aromatik karbokatsiya hosil bo'lishi aromatik yoki ochiq zanjirli karbokatsiya hosil bo'lishiga qaraganda ancha tezroq. Kabi ko'plab reaktsiya sxemalarida karbokatsiyalarning rolini hisobga olgan holda SN1 masalan, boshlang'ich materiallarning konjugatsiyasini tanlash konferentsiya uchun kuchli usul bo'lishi mumkin kinetik qulaylik yoki noqulaylik, chunki har qanday qadam uchun tezlik konstantasi pog'onaning aktivatsiya energiyasiga bog'liq Arreniy tenglamasi.
Giperkonjugatsiyaning ta'siri karbokatsiyalar uchun kuchli darajada barqarorlashadi: alkil o'rnini bosuvchi moddalar bilan giperkondjugatsiya ko'pincha π tizimi bilan konjugatsiyaga qaraganda barqarorlashadi yoki hatto undan ham ko'proqdir. To'yinmagan guruhlarga konjugatsiya qilish mezomerik ta'sir (rezonans) bilan sezilarli darajada barqarorlashishiga olib keladigan bo'lsa-da, foyda qisman ko'proq elektronegativ sp borligi bilan qoplanadi.2 yoki karbokatsion markaz yonidagi sp uglerod. Shunday qilib, gidrid ionlarining yaqinliklari aks etganidek, ikkilamchi karbokatsiya allil kationiga qaraganda ancha barqarorlashadi, uchinchi karbokatsiya esa benzil kationiga nisbatan ancha barqarorlashadi - natijalar bir qarashda qarama-qarshi bo'lib ko'rinishi mumkin.
Oksokarboniy va iminium ionlari uglerod musbat zaryad oladigan muhim ikkilamchi kanonik shakllarga (rezonans tuzilmalariga) ega. Shunday qilib, ular IUPAC ta'rifiga binoan karbokatsiyalardir, ammo ba'zi kimyogarlar ularni "haqiqiy" karbokatsiya deb hisoblamaydilar, chunki ularning eng muhim rezonans hissadorlari mos ravishda kislorod yoki azot atomiga rasmiy musbat zaryad etkazadilar.
Klassik bo'lmagan ionlar
Kabi ba'zi karbokatsiyalar 2-norboril kationi ko'p yoki kamroq nosimmetrik uch markazli ikki elektronli bog'lanishni namoyish eting. Deb nomlangan bunday tuzilmalar klassik bo'lmagan karbokatsiyalar, molekulaning b-ramkasida ishtirok etgan bog'lanishlarni delokalizatsiyasini o'z ichiga oladi, natijada fraksiyonel bog'lanish tartibidagi C-C va C-H bog'lanishlar hosil bo'ladi.[32] Ushbu delokalizatsiya kationning qo'shimcha stabillashishiga olib keladi. Masalan, klassik karbenium ioni sifatida tasvirlangan 2-norbornil kationi ikkinchi darajali karbokatsiya bo'lib ko'rinadi. Biroq, bu odatiy "ikkilamchi" karbokatsiyaga qaraganda ancha barqarordir, taxminan uchinchi darajali karbokatsiya kabi barqarordir. t-butil kation, gidrid ionlarining yaqinligiga muvofiq.
Klassik bo'lmagan karbokatsiyalarning mavjudligi bir paytlar katta tortishuvlarga sabab bo'lgan. Qarama-qarshi tomonlar edi jigarrang Klassik bo'lmagan karbokatsiya ko'rinadigan narsa tez muvozanatlashadigan ikkita klassik turning o'rtacha qiymatini anglatadi (yoki ehtimol biron bir darajadagi ko'prik yoki suyanishni ko'rsatadigan, ammo shunga qaramay nosimmetrik emas) ikkita struktura) va haqiqiy klassik bo'lmagan tuzilish ikki potentsial energiya minimami orasidagi o'tish holati va Vinshteyn Simmetriya tekisligiga ega bo'lgan klassik bo'lmagan tuzilma yagona potentsial energiya minimumi va klassik tuzilmalar bu klassik bo'lmagan turlarning faqat ikkita hissa qo'shadigan rezonans shakllari ekanligiga ishongan. Jorj Olax Karbokatsiyalarni to'g'ridan-to'g'ri kuzatishga imkon beradigan superatsidik vositalarni kashf qilish, Martin Sonders tomonidan ikkita stsenariyni ajratish uchun ishlab chiqilgan juda sezgir NMR texnikasi bilan birgalikda, ushbu qarama-qarshilikni hal qilishda muhim rol o'ynadi.[33][34] Hech bo'lmaganda 2-norbornil kationining o'zi uchun tortishuvlar juda ko'p Vinshteyn foydasiga hal qilindi, hatto 6 K darajagacha bo'lgan haroratda ham o'zaro bog'liq klassik klassik belgilar yo'qligi va 2013 yildagi kristal tuzilishi aniq klassik bo'lmaganligini ko'rsatmoqda tuzilishi.[35][30] Turli xil karbokatsiyalar (masalan, etil kation, yuqoriga qarang) endi klassik bo'lmagan tuzilmalarni qabul qilishiga ishonishadi. Biroq, ko'p hollarda, mumkin bo'lgan "klassik" tuzilmalar va "klassik bo'lmagan" tuzilmalar o'rtasidagi energiya farqi juda kichik va bu ikki imkoniyatni eksperimental ravishda ajratish qiyin bo'lishi mumkin.
Maxsus karbokatsiyalar
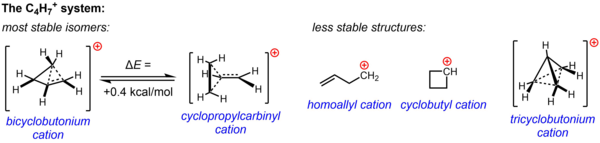
C uchun klassik bo'lmagan tuzilish4H7+ nukleofil bo'lmagan muhitda o'tkazilgan solvoliz tajribalari va NMR tadqiqotlarining muhim eksperimental dalillari bilan qo'llab-quvvatlanadi. Ikkala tuzilmaning bittasi yoki ikkalasi - siklopropilkarbinil kationi va bikiklobutonium kationi turli xil tajribalarda kuzatilgan reaktivlikni hisobga olish uchun chaqirilgan, NMR ma'lumotlari esa shunchaki ikkitadan iborat o'rtacha spektrni berish uchun tezkor qayta tuzilishga o'tadigan yuqori oqim sistemasiga ishora qiladi. 13-132 ° S gacha bo'lgan haroratda ham N NMR signallari. Hisoblash yo'li bilan C ning energetik manzarasi tasdiqlangan4H7+ sistema juda tekis va tajriba ma'lumotlari asosida postulatsiya qilingan ikki izomer energiyaga juda yaqin, bikiklobutonium tuzilishi siklopropilkarbinil tuzilishga nisbatan atigi 0,4 kkal / mol barqarorroq hisoblanadi. Eritma bosqichida (SbF)5-XO2ClF-SO2F2, SbF bilan6– Bikiklobutonium tuzilishi siklopropilkarbinil tuzilmasidan 84:16 nisbatda –61 ° C da ustunlik qiladi.
Mumkin bo'lgan yana uchta struktura, ikkita klassik struktura (homoalil kationi va siklobutil kationi) va ancha yuqori darajadagi delokalizatsiya qilingan klassik bo'lmagan struktura (trisiklobutonium ioni), hozirgi kunda kamroq barqaror izomerlar (yoki shunchaki energiya minimumi o'rniga o'tish holati) sifatida tanilgan. siklobutil kationi holatida).[36]
O'rniga qo'yilgan siklopropilkarbinil kationlari NMR tomonidan ham o'rganilgan:[37][38]
Dimetil lotinining NMR spektrida ikkita metil guruhi uchun ikkita tengsiz signal topiladi, bu esa molekulyar konformatsiya Ushbu kationning oynasi tekislikka ega bo'lgan perpendikulyar emas (A da bo'lgani kabi), lekin siklopropil halqa tizimiga parallel ravishda bo'sh p-orbital bilan ikkiga bo'linadi (Bda bo'lgani kabi):
Xususida egilgan bog'lanish nazariya, bu afzallik qulay deb taxmin qilinadi orbital qoplama to'ldirilgan siklopropan bilan bog'langan bog'lanishlar va bo'sh p-orbital o'rtasida.[39]
Piramidal karbokatsiya
| Piramidal karbokatsiyalar | ||
|---|---|---|
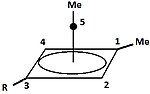 | 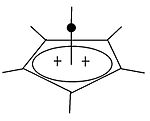 | Klassik va klassik bo'lmagan karbokatsiyalardan tashqari, uchinchi sinfni ajratish mumkin: piramidal karbokatsiyalar. Ushbu ionlarda bitta uglerod atomi to'rt yoki besh qirrali bo'ylab harakatlanadi ko'pburchak, aslida a piramida. The kvadrat piramidal ioni +1 zaryadga ega bo'ladi Besh burchakli piramidal ion +2 ko'taradi. Otxona olti burchakli-piramidal tropiliy uchburchagi konfiguratsiyasi, (C7H7)3+, shuningdek, bashorat qilingan.[40] Bunday holda, uglerodning koordinatsion soni etti ga etadi. [C] ning kristalli tuzilishi6(CH3)6] [SbF6]2• HSO3F geksametilbenzol diktsiyasining beshburchak-piramidal shaklini tasdiqlaydi.[41] |
| Bir valentli karbokatsiyaga misol | Ikki valentli karbokatsiyaga misol |
Shuningdek qarang
Adabiyotlar
- ^ "Karbokatsiya". Oksford lug'atlari Buyuk Britaniya lug'ati. Oksford universiteti matbuoti. Olingan 2016-01-21.
- ^ Grutsmaxer, Xansyorg; Marchand, Kristina M. (1997). "Heteroatom stabilizatsiya qilingan karbenium ionlari". Muvofiqlashtiruvchi. Kimyoviy. Vah. 163: 287–344. doi:10.1016 / S0010-8545 (97) 00043-X.
- ^ Robert B. Grossman (2007-07-31). Organik reaktsiya mexanizmlarini yozish san'ati. Springer Science & Business Media. pp.105 –. ISBN 978-0-387-95468-4.
- ^ Olax, Jorj A. (1972). "Barqaror karbokatsiyalar. CXVIII. Tetrakoordinatsiyalangan (klassik bo'lmagan) karboniy ionlarining uch markazli bog'langan penta-dan uch valentli (klassik) karbenium ionlarini differentsiatsiyalashga asoslangan karbokatsiyalarning umumiy tushunchasi va tuzilishi. Karbokatsiyalarning elektrofil reaktsiyalardagi o'rni". J. Am. Kimyoviy. Soc. 94 (3): 808–820. doi:10.1021 / ja00758a020.
- ^ Sommer, J .; Jost, R. (2000-01-01). "Kichik alkanlar suyuq va qattiq oksidli katalizlangan faollashuvidagi karbeniy va karboniy ionlari". Sof va amaliy kimyo. 72 (12): 2309–2318. doi:10.1351 / pac200072122309. ISSN 1365-3075.
- ^ Kimyo, Xalqaro amaliy ittifoq (2009), "Karbokatsiya", IUPAC Kimyoviy terminologiyalar to'plami, IUPAC, doi:10.1351 / goldbook.C00817, ISBN 978-0967855097, olingan 2018-11-03
- ^ MakMurri, Jon. Organik kimyo (5-nashr). ISBN 978-0-534-37617-8.
- ^ Vollhardt, K. Piter S.; Shor, Nil Erik (2018). Organik kimyo: Tuzilishi va vazifasi (8-nashr). Nyu York. ISBN 9781319079451. OCLC 1007924903.
- ^ Yurkanis Bruice, Paula (2004). Organik kimyo (4-nashr). ISBN 978-0-13-140748-0.
- ^ Kleyden, Jonatan; Grivves, Nik; Uorren, Styuart; Xafa qiladi, Piter (2001). Organik kimyo (1-nashr). Oksford universiteti matbuoti. ISBN 978-0-19-850346-0.
- ^ Tulki, Meri Anne; Uaytsell, Jeyms K. (1997). Organik kimyo. ISBN 978-0-7637-0413-1.
- ^ Merling, G. (1891). "Ueber Tropin". Berichte der Deutschen Chemischen Gesellschaft. 24 (2): 3108–3126. doi:10.1002 / cber.189102402151. ISSN 0365-9496.
- ^ Doering, V. fon E.; Noks, L. H. (1954). "Sikloheptatrienil (Tropil) ioni". J. Am. Kimyoviy. Soc. 76 (12): 3203–3206. doi:10.1021 / ja01641a027.
- ^ "Bir hil organokatalizator sifatida tritil xloriddan foydalangan holda in situ karbokatsion tizimning kashf etilishi". Tetraedr. 69: 212–218. 2013. doi:10.1016 / j.tet.2012.10.042.
- ^ "Imido-efir va boshqa karbimid hosilalarining tuzlari konstitutsiyasi to'g'risida". Am. Kimyoviy. J. 21: 101. ISSN 0096-4085.
- ^ Meerwein, H.; Emster, K. van (1922). "Bornil xlorid izobornil xlorid va kamfen xlorohidrat o'rtasidagi muvozanat izomeriyasi to'g'risida". Berichte. 55: 2500.
- ^ Rzepa, H. S .; Allan, S. S. M. (2010). "Isobornil xloridni karbokatsiyalar orqali rasemizatsiyasi: klassik mexanizmga klassik bo'lmagan ko'rinish". Kimyoviy ta'lim jurnali. 87 (2): 221. Bibcode:2010JChEd..87..221R. doi:10.1021 / ed800058c.
- ^ Doering, V. fon E.; Sonders, M .; Boyton, H. G.; Erxart, H. V.; Vadli, E. F.; Edvards, V. R .; Laber, G. (1958). "1,1,2,3,4,5,6-heptametilbenzenonium ioni". Tetraedr. 4 (1–2): 178–185. doi:10.1016/0040-4020(58)88016-3.
- ^ Hikoya, Pol R.; Saunders, Martin (1960). "7-norbornadienil karboniy ioni". J. Am. Kimyoviy. Soc. 82 (23): 6199. doi:10.1021 / ja01508a058.
- ^ Shleyer, Pol fon R.; Uotts, Uilyam E.; Fort, Raymond S.; Komisarov, Melvin B.; Olax, Jorj A. (1964). "Barqaror karboniy ionlari. X-2 Norbornil kationini to'g'ridan-to'g'ri yadro magnit-rezonans kuzatuvi". J. Am. Kimyoviy. Soc. 86 (24): 5679–5680. doi:10.1021 / ja01078a056.
- ^ Sonders, Martin; Shleyer, Pol fon R.; Olax, Jorj A. (1964). "Barqaror karboniy ionlari. XI.1 2-Norbornil kationidagi gidrid siljish tezligi". J. Am. Kimyoviy. Soc. 86 (24): 5680–5681. doi:10.1021 / ja01078a057.
- ^ Anslin, Erik V.; Dougherty, Dennis A. (2000). Zamonaviy jismoniy organik kimyo. Sausalito, Kaliforniya: Universitet ilmiy kitoblari. ISBN 978-1891389313.
- ^ A., Kerol, Feliks (2010). Organik kimyoda tuzilish va mexanizmning istiqbollari (2-nashr). Xoboken, NJ: Jon Uili. ISBN 9780470276105. OCLC 286483846.
- ^ Olax, Jorj A .; O'Brayen, Daniel X.; Oq, Entoni Mallinson. (1967 yil oktyabr). "Barqaror karboniy ionlari. LII. Protonli esterlar va ularning florosulfonik kislota-antimon antifonid eritmasidagi parchalanishi". Amerika Kimyo Jamiyati jurnali. 89 (22): 5694–5700. doi:10.1021 / ja00998a036. ISSN 0002-7863.
- ^ 1937-, Keri, Frensis A. (2007). Ilg'or organik kimyo. Sundberg, Richard J., 1938- (5-nashr). Nyu-York: Springer. ISBN 9780387448978. OCLC 154040953.CS1 maint: raqamli ismlar: mualliflar ro'yxati (havola)
- ^ H., Louri, Tomas (1987). Organik kimyoda mexanizm va nazariya. Richardson, Ketlin Shueller. (3-nashr). Nyu-York: Harper va Row. ISBN 0060440848. OCLC 14214254.
- ^ Shults, Jocelyn C.; Xoul, F. A .; Beauchamp, J. L. (1984 yil iyul). "1-propil, 1-butil, izobutil, neopentil va 2-butil radikallarining fotoelektron spektroskopiyasi: yuqori energiyali karboniy ioni izomerlarining erkin radikal prekursorlari". Amerika Kimyo Jamiyati jurnali. 106 (14): 3917–3927. doi:10.1021 / ja00326a006. ISSN 0002-7863.
- ^ Yamataka, Xiroshi; Ando, Takashi; Nagase, Shigeru; Xanamura, Mitsuyasu; Morokuma, Keiji (1984 yil fevral). "Ab initio MO neopentil Ester solvolizining model jarayonlarida izotop ta'sirini hisoblashi". Organik kimyo jurnali. 49 (4): 631–635. doi:10.1021 / jo00178a010. ISSN 0022-3263.
- ^ Anjelini, Jankarlo.; Xanak, Maykl.; Vermehren, Jan .; Speranza, Mauritsio. (1988-02-17). "Alkinil kationini hosil qilish va tuzoqqa tushirish". Amerika Kimyo Jamiyati jurnali. 110 (4): 1298–1299. doi:10.1021 / ja00212a052. ISSN 0002-7863.
- ^ a b Scholz, F .; Himmel, D .; Geynemann, F. V.; Shleyer, P. v R.; Meyer, K .; Krossing, I. (2013-07-05). "Klassik bo'lmagan 2-Norbornil kationining kristalli tuzilishini aniqlash". Ilm-fan. 341 (6141): 62–64. Bibcode:2013Sci ... 341 ... 62S. doi:10.1126 / science.1238849. ISSN 0036-8075. PMID 23828938.
- ^ Aue, Donald H. (2011). "Carbocations". Simlar hisoblash molekulyar fanlari. 1 (4): 487–508. doi:10.1002 / wcms.12. ISSN 1759-0884.
- ^ Qisqacha aytganda, alkil bilan almashtirilgan karbokatsiyalarning giperkonjugativ stabillashuvi uch markazli bog'lanishning bir turi. Geometrik ravishda giperkonjugatsiyaga aloqador bo'lgan C-H bog'lanishlari kuzatiladi (yoki hisoblab chiqiladi), natijada karbokatsion markazga ozgina "egilib" (ya'ni C+–C – H bog'lanish burchagi biroz pasayadi). Shunga qaramay, vodorod atomi hali ham mavjud birinchi navbatda a uglerod bilan katyonik uglerodga bog'langan. Klassik bo'lmagan karbokatsiya sifatida qatnashish uchun ikkita elektronli uchta markaz bog'lanishida ikkita elektron etishmayotgan markazga teng (yoki deyarli teng) bog'langan guruh bo'lishi kerak. Amalda, qo'shni guruhning ozgina ishtirok etishidan (kuchsiz giperkonjugatsiya) tortib, qo'shni markazlar o'rtasida bir guruhning teng ulushidan (umuman klassik bo'lmagan bog'lanish) tortib, mumkin bo'lgan bog'lanish sxemalarining doimiyligi mavjud.
- ^ Olax, Jorj A .; Prakash, G. K. Surya; Saunders, Martin (2002 yil may). "2-norbornil kationini tizimli o'rganish asosida klassik-klassik bo'lmagan ion bahsini yakunlash". Kimyoviy tadqiqotlar hisoblari. 16 (12): 440–448. doi:10.1021 / ar00096a003.
- ^ Jorj A. Olax - Nobel ma'ruzasi
- ^ Yannoni, C. S .; Myre, P. S.; Veb, Gretxen G. (1990 yil noyabr). "Suyuq-geliy haroratiga yaqin bo'lgan yadro magnit-rezonansining sehrli burchagi. 2-norboril kationining o'zgaruvchan haroratli CPMAS spektrlari 6 K". Amerika Kimyo Jamiyati jurnali. 112 (24): 8991–8992. doi:10.1021 / ja00180a060. ISSN 0002-7863.
- ^ Olax, Jorj A .; Surya Prakash, G. K .; Rasul, Golam (2008 yil iyul). "Ab Initio / GIAO-CCSD (T) C 4 H 7 + va C 5 H 9 + ionlarining tuzilmalari, energiyalari va 13 C NMR kimyoviy siljishlarini o'rganish: siklopropilkarbinilning nisbiy barqarorligi va dinamik tomonlari va bisiklobutonium ionlari". Amerika Kimyo Jamiyati jurnali. 130 (28): 9168–9172. doi:10.1021 / ja802445s. ISSN 0002-7863.
- ^ Kabakoff, Devid S .; Namanvort, Eli (1970). "Dimetilsiklopropilkarbinil kationining yadro magnitli ikki rezonansli tadqiqotlari. Aylanish to'sig'ini o'lchash". J. Am. Kimyoviy. Soc. 92 (10): 3234–3235. doi:10.1021 / ja00713a080.
- ^ Kichik Pittman, Charlz U.; Olax, Jorj A. (1965). "Barqaror karboniy ionlari. XVII.1a tsiklopropil karboniy ionlari va protonlangan siklopropil ketonlar". J. Am. Kimyoviy. Soc. 87 (22): 5123–5132. doi:10.1021 / ja00950a026.
- ^ Kerey, F.A .; Sundberg, R.J. Ilg'or organik kimyo A qismi (2-nashr).
- ^ Vang, Jorj; Rahmon, A. K. Fazlur; Vang, Bin (may, 2018). "Geptakordordik uglerod bilan ionli uglevodorod birikmalarining Ab initio hisob-kitoblari". Molekulyar modellashtirish jurnali. 24 (5): 116. doi:10.1007 / s00894-018-3640-9. ISSN 1610-2940. PMID 29696384.
- ^ Malischevskiy, Morits; Seppelt, K. (2016-11-25). "Pentagonal-piramidal geksametilbenzolning Dication C ning kristalli tuzilishini aniqlash6(CH3)62+". Angewandte Chemie International Edition. 56 (1): 368–370. doi:10.1002 / anie.201608795. ISSN 1433-7851. PMID 27885766.
Tashqi havolalar
 Bilan bog'liq ommaviy axborot vositalari Karbokatsiyalar Vikimedia Commons-da
Bilan bog'liq ommaviy axborot vositalari Karbokatsiyalar Vikimedia Commons-da- Matbuot xabari 1994 yil kimyo bo'yicha Nobel mukofoti ". Nobelprize.org. 9 iyun 2010 yil