Kleysen kondensatsiyasi - Claisen condensation
| Kleysen kondensatsiyasi | |
|---|---|
| Nomlangan | Rayner Lyudvig Klezen |
| Reaksiya turi | Birlashish reaktsiyasi |
| Identifikatorlar | |
| Organik kimyo portali | kleysen-kondensatsiya |
| RSC ontologiya identifikatori | RXNO: 0000043 |
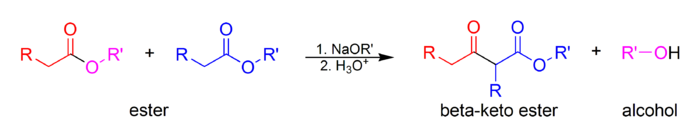
The Kleysen kondensatsiya a uglerod-uglerod aloqasi shakllantirish reaktsiya bu ikkalasi o'rtasida sodir bo'ladi Esterlar yoki bitta ester va boshqasi karbonil ishtirokida birikma kuchli tayanch natijada b-keto esteri yoki β-diketon.[1] Uning nomi berilgan Rayner Lyudvig Klezen, birinchi marta 1887 yilda reaktsiya haqidagi asarini nashr etdi.[2][3][4]
Talablar
Ulardan kamida bittasi reaktivlar bo'lishi kerak enolizable (bor a-proton va o'tishi mumkin deprotonatsiya shakllantirish enionat anion ). Bir necha xil hosil qiluvchi fermentlashtiriladigan va nolga aylanmaydigan karbonil birikmalarining bir qator turli xil birikmalari mavjud turlari Kleysen.
Amaldagi asos reaktsiyaga xalaqit bermasligi kerak nukleofil almashtirish yoki qo'shimcha karbonil uglerod bilan Shu sababli natriy konjugati alkoksid hosil bo'lgan spirtning asosi (masalan, natriy etoksid agar etanol hosil bo'ladi) ko'pincha ishlatiladi, chunki alkoksid qayta tiklanadi. Aralashtirilgan Klezen kondensatsiyasida, a nukleofil bo'lmagan asos kabi lityum diizopropilamid yoki LDA dan foydalanish mumkin, chunki faqat bitta birikma enolizatsiyalanadi. LDA odatda Klassen klassikasida ishlatilmaydi yoki Dieckmann kondensatlari ning enolizatsiyasi tufayli elektrofil Ester.
Esterning alkoksi qismi nisbatan yaxshi bo'lishi kerak guruhdan chiqish. Metil va etil hosil bo'lgan esterlar metoksid va etoksid navbati bilan odatda ishlatiladi.
Turlari
- Klassenning mumtoz kondensatsiyasi, tarkibida enolizlanadigan ester bo'lgan birikmaning ikki molekulasi orasidagi o'z-o'zidan kondensatsiya.
- Aralashtirilgan (yoki "kesib o'tgan") klizen kondensatsiyasi, bu erda bitta fermentlashtiruvchi ester yoki keton va bitta yadrolanmaydigan ester ishlatiladi.
- The Dieckmann kondensatsiyasi, bu erda ikkita Ester guruhi bo'lgan molekula reaksiyaga kirishadi Molekulyar ravishda, shakllantirish a tsiklik b-keto ester. Bunday holda, hosil bo'lgan halqa bo'lmasligi kerak taranglashgan, odatda 5 yoki 6 a'zoli zanjir yoki halqa.
Mexanizm

Mexanizmning birinchi bosqichida a-proton kuchli tayanch yordamida chiqariladi, natijada enolat anion hosil bo'ladi, uni nisbatan barqaror qiladi delokalizatsiya elektronlar. Keyinchalik (boshqa) esterning karbonil uglerodiga enolat anioni nukleofil hujumga uchraydi. Keyin alkoksi guruhi yo'q qilinadi (natijada (qayta) alkoksid hosil bo'ladi) va alkoksid yangi hosil bo'lgan ikki baravar a-protonni chiqarib, yuqori rezonansli stabillashgan enol anionini hosil qiladi. Suvli kislota (masalan, sulfat kislota yoki fosfor kislotasi ) ga oxirgi bosqichda qo'shiladi zararsizlantirish hozirgacha mavjud bo'lgan har qanday baza. Keyin yangi hosil bo'lgan b-keto ester yoki b-diketon ajratib olinadi. E'tibor bering, reaktsiya a ni talab qiladi stexiometrik a-protonning ikki barobar ko'paytirilishi bilan asosning miqdori boshqacha ta'sir qiladi endergonik reaktsiya. Ya'ni, Klezen kondensatsiyasi ishlamaydi substratlar faqat bittasiga ega a-vodorod chunki oxirgi bosqichda b-keto esterini deprotonatsiyalashning harakatlantiruvchi kuchi ta'siri.
 |
| animatsiya |
Stobbe kondensatsiyasi
The Stobbe kondensatsiyasi[5] dietil uchun xos bo'lgan modifikatsiyadir Ester ning süksin kislotasi kamroq kuchli tayanchlarni talab qiladi.[6] Masalan, uning reaktsiyasi benzofenon:[7]
A reaktsiya mexanizmi bu Ester guruhining shakllanishini va a karboksilik kislota guruh a ga asoslangan lakton oraliq (5):
Stobbe kondensatsiyasi Reinhard Sarges sintezining birinchi bosqichida ishlatilgan tametralin[iqtibos kerak ] va u ham sintezida ishlatilishi mumkin dimefadane.[iqtibos kerak ]
Shuningdek qarang
Adabiyotlar
- ^ Carey, F. A. (2006). Organik kimyo (6-nashr). Nyu-York, NY: McGraw-Hill. ISBN 0-07-111562-5.
- ^ Kleysen, L .; Claparede, A. (1881). "Kondensator fon v Ketonen mit Aldehyden". Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2460–2468. doi:10.1002 / cber.188101402192.
- ^ Kleysen, L. (1887). "Ueber Einführung von Säureradicalen Ketonda vafot etadi". Berichte der Deutschen Chemischen Gesellschaft. 20 (1): 655–657. doi:10.1002 / cber.188702001150.
- ^ Xauzer, C. R .; Xadson, kichik B. E. (1942). "Asetoacetic Ester kondensatsiyasi va shunga o'xshash ba'zi reaktsiyalar". Organik reaktsiyalar. 1: 266–302. doi:10.1002 / 0471264180.or001.09. ISBN 0471264180.
- ^ Stobbe, H. (1899). "Condensation des Benzophenons mit Bernsteinsäureester". Yustus Libigs Annalen der Chemie. 308 (1–2): 89–114. doi:10.1002 / jlac.18993080106.
- ^ Mart, Jerri (1985), Ilg'or organik kimyo: reaktsiyalar, mexanizmlar va tuzilish (3-nashr), Nyu-York: Uili, ISBN 0-471-85472-7
- ^ Jonson, V. S.; Schneider, W. P. (1950). "β-CARBETHOXY-γ, γ-DIPHENYLVINYLACETIC kislotasi" (PDF). Organik sintezlar. 30: 18.; Jamoa hajmi, 4, p. 132
Tashqi havolalar
- "Klisen kondensatsiyasi". Organik kimyo portali.





