Sikloheksan konformatsiyasi - Cyclohexane conformation

A sikloheksan konformatsiyasi a tomonidan qabul qilingan bir necha uch o'lchovli shakllarning har qanday biri sikloheksan molekula. Ko'pgina birikmalar strukturaviy o'xshash olti a'zoli halqalarni o'z ichiga olganligi sababli, sikloheksanning tuzilishi va dinamikasi keng assortimentning muhim prototipidir.[1][2]
The ichki burchaklar kvartiraning muntazam olti burchak 120 ° ga teng, afzalroq ketma-ket bog'lanishlar orasidagi burchak a uglerod zanjir taxminan 109,5 ° ga teng tetraedral burchak. Shuning uchun sikloheksan halqasi barcha burchaklari 109,5 ° ga yaqin va shuning uchun pastroq bo'lgan ba'zi tekis bo'lmagan (egilgan) konformatsiyalarni qabul qilishga intiladi. kuchlanish energiyasi olti burchakli tekis Eng muhim shakllar kafedra, yarim stul, qayiqva burama qayiq. Ularning nisbiy barqarorligi quyidagilardir: stul> burama qayiq> qayiq> yarim stul. Barcha nisbiy konformatsion energiya quyida keltirilgan.[3][4] Molekula ushbu konformatsiyalar orasida bemalol o'tishi mumkin va ulardan faqat ikkitasi -kafedra va burama qayiq- sof shaklda ajratilishi mumkin.
Asosiy konformerlar
Kafedraning konformatsiyasi
Kafedraning konformatsiyasi eng barqaror konformer hisoblanadi. 25 ° C da sikloheksan eritmasidagi barcha molekulalarning 99,99% bu konformatsiyani qabul qiladi.
The simmetriya bu D.3d. Barcha uglerod markazlari tengdir. Oltita vodorod markazlari eksenel holatlarda, taxminan C ga parallel ravishda joylashtirilgan3 o'qi. Oltita vodorod atomi C ga perpendikulyar ravishda joylashtirilgan3 simmetriya o'qi. Ushbu H atomlari mos ravishda eksenel va ekvatorial deb nomlanadi.
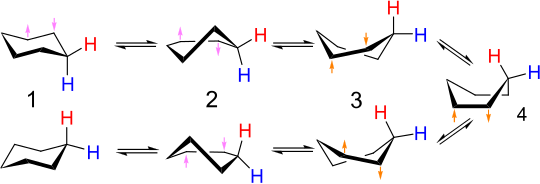
Har bir uglerod bitta "yuqoriga" va bitta "pastga" vodorodga ega. Ketma-ket uglerodlardagi C-H bog'lanishlari shunday dovdirab qoldi shuning uchun oz narsa bor burama kuchlanish. Vodorod atomlari almashtirilganda stul geometriyasi ko'pincha saqlanib qoladi galogenlar yoki boshqa oddiy guruhlar.
Qayiq va burama qayiq konformatsiyalari
Qayiq konformatsiyalari stul konformatsiyalariga qaraganda yuqori energiyaga ega. Ikkalasining o'zaro ta'siri bayroq ustuni xususan, gidrogenlarni hosil qiladi sterik shtamm. Burulma shtammlari ham mavjud bo'lgan C2-C3 va C5-C6 bog'lanishlari orasida mavjud tutilgan. Ushbu zo'riqish tufayli qayiq konfiguratsiyasi beqaror (ya'ni mahalliy energiya minimal emas).
The molekulyar simmetriya bu C2v.
Qayiq konformatsiyalari o'z-o'zidan burama qayiq konformatsiyalarini buzadi. Mana simmetriya bu D.2, faqat aylanma nuqta guruhi. Ushbu konformatsiya ikki juft metilen guruhining tutilishini olib tashlash uchun molekulaga ozgina burish orqali qayiq konformatsiyasidan olinishi mumkin.
Xona haroratida burama qayiq konformatsiyasining kontsentratsiyasi 0,1% dan kam, ammo 1073 da kelvinlar u 30% ga etishi mumkin. Sikloheksan namunasining 1073 K dan 40 K gacha tez sovishi burama qayiq konformatsiyasining katta kontsentratsiyasida muzlaydi va u asta sekin qizdirilganda stul konformatsiyasiga aylanadi.[5]
Dinamika
Kafedra kafedrasi
Kafedra konformerlarining o'zaro konversiyasi deyiladi uzukni aylantirish yoki stulni ag'darish. Bir konfiguratsiyada eksenel bo'lgan uglerod-vodorod aloqalari ikkinchisida ekvatorial bo'ladi va aksincha. Xona haroratida ikkita stul tezda mos keladi muvozanatlashtirmoq. The proton NMR spektri sikloheksan - xona haroratidagi singlet.
Kafedraning o'zaro konversiyasining batafsil mexanizmi ko'plab tadqiqotlar va munozaralarga sabab bo'ldi.[6] The yarim kreslo davlati (D., quyidagi rasmda) kalit o'tish holati stul va burama qayiq konformatsiyalari o'rtasidagi o'zaro bog'liqlikda. Yarim stulda C2 simmetriya. Ikki stul konformatsiyasi orasidagi o'zaro bog'liqlik quyidagi ketma-ketlikni o'z ichiga oladi: stul → yarim stul → burilish qayiq → yarim stul ′ → stul ′.
Qaytib qayiq - burama qayiq
Qayiq konformatsiyasi (C, quyida) - bu o'tish holati, bu ikki xil burama qayiq konformatsiyasining o'zaro almashinuviga imkon beradi. Qayiq konformatsiyasi bo'lmasa ham zarur sikloheksanning ikkita stul konformatsiyalari orasidagi o'zaro bog'liqlik uchun u ko'pincha tarkibiga kiradi reaksiya koordinatalari diagrammasi bu o'zaro konversiyani tasvirlash uchun ishlatiladi, chunki uning energiyasi yarim stulnikidan ancha past, shuning uchun burilish qayiqdan stulga o'tish uchun etarli energiyaga ega bo'lgan har qanday molekula ham burilish qayiqdan qayiqqa o'tish uchun etarli energiyaga ega. Shunday qilib, burilish qayiq konformatsiyasidagi sikloheksan molekulasi yana stul konformatsiyasiga erishishi mumkin bo'lgan bir nechta yo'llar mavjud.
 Muvofiqliklar: kafedra (A), burilish qayig'i (B), qayiq (C) va yarim stul (D.). Energiya 43 kJ / mol (10 kkal / mol), 25 kJ / mol (6 kkal / mol) va 21 kJ / mol (5 kkal / mol) ni tashkil qiladi.[3]
Muvofiqliklar: kafedra (A), burilish qayig'i (B), qayiq (C) va yarim stul (D.). Energiya 43 kJ / mol (10 kkal / mol), 25 kJ / mol (6 kkal / mol) va 21 kJ / mol (5 kkal / mol) ni tashkil qiladi.[3]
Almashtirilgan hosilalar

Sikloheksanda ikkala stul konformatsiyasi bir xil energiyaga ega. Vaziyat ancha murakkab, o'rnini bosuvchi hosilalar. Yilda metilsikloheksan ikkita stul konformatorlari izoenergetik emas. Metil guruhi ekvatorial yo'nalishni afzal ko'radi. Ekvatorial konformatsiyaga nisbatan substituententning afzalligi uning jihatidan o'lchanadi Qiymat, bu Gibbs bepul energiya ikki stul konformatsiyasi orasidagi farq. Ijobiy A qiymati ekvatorial holatga nisbatan ustunlikni bildiradi. A qiymatlarining kattaligi juda kichik o'rinbosarlar uchun deyarli noldan o'zgaradi deyteriy kabi juda katta miqdordagi o'rinbosarlar uchun taxminan 5 kkal / mol (21 kJ / mol) gacha tert-butil guruh.
Ajratilgan sikloheksanlar
1,2- va 1,4-ajralgan sikloheksanlar uchun a cis konfiguratsiya bitta eksenel va bitta ekvatorial guruhga olib keladi. Bunday turlar tez, degeneratsiyalangan stulni aylantiradi. 1,2- va 1,4-ajralgan sikloheksan uchun a trans konfiguratsiyasi, diaktsial konformatsiyasi yuqori sterik shtamm bilan samarali oldini olinadi. 1,3 ta almashtirilgan sikloheksanlar uchun cis shakli Diequatorial va aylantirilgan konformatsiya ikkita eksenel guruh o'rtasida qo'shimcha sterik ta'sir o'tkazadi. trans-1,3-Ajratilgan sikloheksanlar o'xshash cis-1,2- va cis-1,4- va ikkita ekvivalent eksa / ekvatorial shakllar o'rtasida aylanishi mumkin.[2]
Cis-1,4-Di-tert-butilsikloheksan eksenelga ega tert-butil guruhdagi konformatsiya va burama qayiq konformatsiyasiga o'tish har ikkala guruhni yanada qulay ekvatorial holatga keltiradi. Natijada, burilish qayig'ining konformatsiyasi 125 K da 0,47 kJ / mol (0,11 kkal / mol) ga nisbatan barqarorroq bo'ladi. NMR spektroskopiyasi.[6]
Geterosiklik analoglar
Sikloheksanning geterosiklik analoglari shakar, piperidin, dioksan va boshqalarda keng tarqalgan bo'lib, ular odatda sikloheksan tendentsiyalariga amal qiladi, ya'ni stul konformatori eng barqaror. Eksenel-ekvatorial muvozanat (A qiymatlari) ga metilenning O yoki NH bilan almashtirilishi ta'sir qiladi. Illyustrativ - ning mosliklari glyukozidlar.[2] 1,2,4,5-Tetratian ((SCH2)3) sikloheksanning noqulay 1,3-diaksial o'zaro ta'siriga ega emas. Binobarin, uning burilish-qayiq konformatsiyasi aholi tomonidan to'ldirilgan; mos keladigan tetrametil tuzilishida 3,3,6,6-tetrametil-1,2,4,5-tetratian, burilish qayiq konformatsiyasi ustunlik qiladi.
Tarixiy ma'lumot
1890 yilda, Hermann Saxse, Berlindagi 28 yoshli yordamchi, o'zi chaqirgan sikloheksanning ikki shaklini aks ettirish uchun qog'oz varag'ini katlama bo'yicha ko'rsatmalarni nashr etdi. nosimmetrik va nosimmetrik (endi nima deyishimiz mumkin kafedra va qayiq). U ushbu shakllar vodorod atomlari uchun ikkita pozitsiyani egallaganligini aniq tushundi (yana zamonaviy terminologiyadan foydalanish uchun, eksenel va ekvatorial), ehtimol ikkita stul o'zaro bir-biriga aylanishi mumkin va hatto ba'zi bir o'rinbosarlar kafedra shakllaridan birini afzal ko'rishlari mumkin (Sachse-Mohr nazariyasi ). U bularning barchasini matematik tilda ifoda etganligi sababli, o'sha davrning ozgina kimyogarlari uning dalillarini tushunganlar. U ushbu g'oyalarni nashr etishga bir necha bor urinib ko'rdi, ammo hech kim kimyogarlarning xayolini jalb qila olmadi. Uning 1893 yilda 31 yoshida vafot etishi uning g'oyalari xiralashganligini anglatadi. Bu faqat 1918 yilda bo'lgan Ernst Mohr, yaqinda o'sha paytdagi juda yangi rentgen-kristallografiya texnikasi yordamida hal qilingan olmosning molekulyar tuzilishiga asoslanib,[7][8] Sachse kreslosi asosiy motiv bo'lganligi haqida muvaffaqiyatli bahslasha oldi.[9][10][11][12][13][14] Derek Barton va G'alati Xassel 1969 yil bilan bo'lishdi Nobel mukofoti sikloheksan va boshqa har xil molekulalarning konformatsiyalari ustida ishlash uchun.
Adabiyotlar
- ^ Eliel, Ernest Lyudvig; Wilen, Samuel H. (2008). Organik birikmalarning stereokimyosi. Villi Hindiston. ISBN 978-8126515707.
- ^ a b v Smit, Maykl B.; Mart, Jerri (2007), Ilg'or organik kimyo: reaktsiyalar, mexanizmlar va tuzilish (6-nashr), Nyu-York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ a b v J, Kleyden (2003). Organik kimyo (2-nashr). Oksford. p. 373. ISBN 9780191666216.
- ^ Nelson, Donna J.; Brammer, Kristofer N. (2011). "Organik kimyo bo'yicha sikloheksan konformatorlari uchun izchil terminologiyaga". J. Chem. Ta'lim. 88 (3): 292–294. Bibcode:2011JChEd..88..292N. doi:10.1021 / ed100172k.
- ^ Skvillakot, M.; Sheridan, R. S .; Chapman, O. L .; Anet, F. A. L. (1975-05-01). "Sikloheksanning burama qayiq konformatsiyasini spektroskopik aniqlash. Kreslo va burilish qayig'i orasidagi erkin energiya farqini to'g'ridan-to'g'ri o'lchash". J. Am. Kimyoviy. Soc. 97 (11): 3244–3246. doi:10.1021 / ja00844a068.
- ^ a b Gill, G.; Pavar, D. M.; Noe, E. A. (2005). "Konformatsion o'rganish cis-1,4-Di-tert-butilsikloheksan - Dinamik NMR spektroskopiyasi va hisoblash usullari. Stul va qayiq konstruktsiyalarini kuzatish ". J. Org. Kimyoviy. 70 (26): 10726–10731. doi:10.1021 / jo051654z. PMID 16355992.
- ^ Bragg, V. H.; Bragg, V. L. (1913). "Olmosning tuzilishi". Tabiat. 91 (2283): 557. Bibcode:1913 yil Natur..91..557B. doi:10.1038 / 091557a0.
- ^ Bragg, V. H.; Bragg, V. L. (1913). "Olmosning tuzilishi". Proc. R. Soc. A. 89 (610): 277–291. Bibcode:1913RSPSA..89..277B. doi:10.1098 / rspa.1913.0084.
- ^ Sakse, H. (1890). "Ueber die geometrischen Isomerien der Hexamethylenderivate". Berichte der deutschen chemischen Gesellschaft (nemis tilida). Vili. 23 (1): 1363–1370. doi:10.1002 / cber.189002301216. ISSN 0365-9496.
- ^ Sakse, H. (1892-01-01). "Über die Konfigurationen der Polymethylenringe". Zeitschrift für Physikalische Chemie. Walter de Gruyter GmbH. 10U (1): 203. doi:10.1515 / zpch-1892-1013. ISSN 2196-7156.
- ^ Sakse, H. (1893-01-01). "Eine Deutung der Affinität". Zeitschrift für Physikalische Chemie. Walter de Gruyter GmbH. 11U (1): 185–219. doi:10.1515 / zpch-1893-1114. ISSN 2196-7156.
- ^ Mohr, Ernst (1918-09-20). "Die Baeyersche Spannungstheorie und die Struktur des Diamanten". Journal für Praktische Chemie (nemis tilida). Vili. 98 (1): 315–353. doi:10.1002 / prac.19180980123. ISSN 0021-8383.
- ^ Mohr, Ernst (1922-01-14). "Zur Theorie dercis-trans-Isomerie des Dekahydro-naftalin". Berichte der deutschen chemischen Gesellschaft. Vili. 55 (1): 230–231. doi:10.1002 / cber.19220550128. ISSN 0365-9488.
- ^ Ushbu tarix bu erda yaxshi xulosa qilingan:[1] Arxivlandi 2012-02-28 da Orqaga qaytish mashinasi.
Qo'shimcha o'qish
- Kolin A. Rassell, 1975 yil, "Konformatsion tahlilning kelib chiqishi" Van 't Hoff-Le Bel Centennial, O. B. Ramsay, Ed. (ACS simpoziumi seriyasi 12), Vashington, Kolumbiya: Amerika kimyo jamiyati, 159–178 betlar.
- Uilyam Reush, 2010 yil, "halqa konformatsiyalari" va "almashtirilgan sikloheksan aralashmalari" Organik kimyo bo'yicha virtual darslik, East Lansing, MI, AQSh: Michigan shtati universiteti, qarang [2] va [3], 2015 yil 20-iyun kuni.

