Fetizon oksidlanish - Fétizon oxidation - Wikipedia
Fetizon oksidlanish bo'ladi oksidlanish birlamchi va ikkilamchi spirtli ichimliklar birikmani ishlatib kumush (I) karbonat yuzasiga singib ketadi selit shuningdek, nomi bilan tanilgan Fétizon reaktivi birinchi marta 1968 yilda Marcel Fétizon tomonidan ishlagan.[1] Bu kislotaga ham, asosga sezgir birikmalarga ham mos keladigan yumshoq reaktivdir. Uning katta reaktivligi laktollar Fétizon oksidlanishini olishning foydali usuliga aylantiradi laktonlar dan diol. Reaksiya tomonidan sezilarli darajada inhibe qilinadi qutbli reaktsiya tizimidagi guruhlar, shuningdek sterik to'siq alkogolning a-vodorodidan iborat.
Tayyorgarlik
Fétizon reaktivi odatda qo'shib tayyorlanadi kumush nitrat ga suvli eritma kabi karbonatning natriy karbonat[2] yoki kaliy bikarbonat,[3] tozalangan selit ishtirokida kuchli aralashtirilganda.
Mexanizm
Spirtli ichimliklarni Fétizon reaktivi bilan oksidlash mexanizmi alkogolli kislorodni ham, vodorod alfani ham spirtga selit yuzasida kumushning (I) ikkita atomining yagona elektron oksidlanishini o'z ichiga oladi. The karbonat keyin ion hosil bo'lgan karbonil hosil qiluvchi bikarbonatni deprotonatsiyalashga kirishadi, bu esa qo'shimcha ravishda hosil bo'lgan vodorod kationi bilan protonlanadi. yo'q qilish ning suv va avlod karbonat angidrid.[4]


Ushbu reaktsiyani tezlikni cheklash bosqichi alkogolning kumush ionlariga boshlang'ich assotsiatsiyasi sifatida taklif etiladi. Natijada, kumush bilan zaif bog'langan ligandlarning mavjudligi reaktsiyani katta darajada inhibe qilishi mumkin. Natijada, har qanday xilma-xillikning ozgina qutbli erituvchilari, masalan etil asetat yoki metil etil keton, ushbu reaktivdan foydalanishda ularni oldini olish kerak, chunki ular reaktiv bilan raqobatbardosh ravishda bog'lanadi.[5] Reaktivning qo'shimcha qutbli funktsiyalaridan, shuningdek, iloji boricha, hatto an mavjud bo'lishidan qochish kerak alken ba'zan substratning reaktivligini 50 baravar kamaytirishi mumkin.[6] Kabi keng tarqalgan ishlaydigan erituvchilar benzol va ksilen nihoyatda kutupsiz va reaktsiyani yanada tezlashtirishga ko'proq qutbsiz foydalanish orqali erishish mumkin geptan.[6] Erituvchi, shuningdek, reaktsiyani issiqlik bilan haydash va reaktsiya natijasida hosil bo'lgan suvni olib tashlash uchun odatda qaytariladi azeotropik distillash.Vodorod alfaning alkogolga to'sqinlik qilishi oksidlanish tezligini asosiy belgilaydi, chunki u assotsiatsiya tezligiga ta'sir qiladi.[5] Alfa vodorodga ega bo'lmagan uchlamchi spirtli ichimliklar tanlanadi va odatda Fetizon reaktivi ishtirokida oksidlanmaydi.[7]

Reaktivda ishlatiladigan selit miqdorini ko'paytirish reaksiya uchun mavjud bo'lgan sirt hajmini oshirib, reaktsiya tezligini tezlashtiradi. Shu bilan birga, bir mol kumush (I) karbonat uchun 900 grammdan oshgan selit miqdorini ko'paytirish suyultirish ta'siri tufayli reaktsiyani sekinlashtira boshlaydi.[5]
Reaktivlik
Fétizon reaktivi asosan birlamchi yoki ikkilamchi spirtlarning oksidlanishida ishlatiladi aldegidlar yoki ketonlar ikkilamchi spirtli ichimliklarni ozgina tanlab olish bilan[8] va to'yinmagan spirtli ichimliklar.[1] Reaktsiya odatda ko'p aralashtirish bilan qaytariladigan quruq qutbsiz organik erituvchida amalga oshiriladi. Reaktsiya vaqti alkogolning tuzilishiga qarab o'zgaradi va odatda uch soat ichida yakunlanadi. Fetizon reaktivining juda jozibali xususiyati bu reaksiya mahsulotidan fizik ravishda filtrlash va benzol bilan yuvish orqali ajralib chiqish qobiliyatidir. Fetizon reaktivining uchinchi darajali spirtlarni oksidlay olmasligi, uni alkogollardan biri uchinchi darajali bo'lgan [1,2] diolning monooksidlanishida juda foydali qiladi, bu esa uglerod-uglerod bog'lanishining parchalanishiga yo'l qo'ymaydi.[7]

Reaktivning yumshoqligi va tizimli sezgirligi, shuningdek, ushbu reaktivni nosimmetrik diolning monooksidlanishi uchun ideal qiladi.[8]

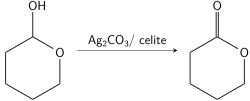
Laktollar Fetizon reaktiviga juda sezgir bo'lib, laktonning ishlashiga juda tez oksidlanadi. Bu laktollarni boshqa spirtli ichimliklar ishtirokida tanlab oksidlanishiga imkon beradi.[9] Bu shuningdek, birlamchi dioldan laktonlarni hosil qilish uchun Fétizon reaktividan klassik foydalanishga imkon beradi. Alkogollardan birini aldegidga oksidlash orqali ikkinchi alkogol aldegid bilan muvozanatlashadi va laktol hosil qiladi, u tezroq Fetizon reaktivi bilan reaksiyaga kirishib, tsiklik oraliqni lakton sifatida ushlaydi.[8] Ushbu usul an'anaviy ravishda sintez qilish qiyinroq bo'lgan etti a'zoli laktonlarni sintez qilishga imkon beradi.[10]

Fenol funktsional guruhlar o'zlariga mos ravishda oksidlanishi mumkin kinon shakllari. Ushbu xinonlar ko'p miqdordagi eritma tarkibida birlashishi mumkin o'lchovlar ularning o'rinbosarlariga qarab.[2]

Ominlar Fetizon reaktivi ishtirokida oksidlanishi isbotlangan eminlar[11] va iminium tuzoqqa tushgan kationlar,[12] ammo osonroq oksidlangan alkogolli funktsiyalarga ega bo'lgan birikmada ham tanlanishi mumkin.[13]Fétizon reaktivini osonlashtirish uchun ham ishlatish mumkin cycloaddition dihidrofurokinolinonlarni hosil qilish uchun 4-gidroksi-2-furokinilon va olefindan iborat.[14]
Guruhlarni himoya qilish
Para-metoksibenzil (PMB) odatda spirtli ichimliklarni Fetizon reaktividan himoya qiluvchi guruhdir.[15] Fetizon oksidlanishi neytral reaktsiya bo'lgani uchun kislota va asosga sezgir himoya qiluvchi guruhlar ham reaktivga va hosil bo'lgan mahsulotlarga mos keladi.
Nozik guruhlar
Uchinchi darajali spirtli ichimliklar odatda Fétizon reaktiviga ta'sir qilmasa ham, uchinchi darajali propargil spirtlari ushbu sharoitda oksidlanib, alkogolning an bilan parchalanishiga olib keladi alkin guruhdan chiqish.[16]

Galohidrinlar trans stereokimyosiga ega bo'lganlarning shakllanishi isbotlangan epoksidlar va Fetizon reaktivi ishtirokida transplantatsiya qilingan mahsulotlar. Sis-stereokimyoga ega bo'lgan halogidrinlar odatdagidek Fetizonning ketonga oksidlanishini bajaradi.[17]

[1,3] diollar Fetizon reaktivi tomonidan monooksidlanish natijasida suvni yo'q qilish tendentsiyasiga ega. enone.[8]

Turli xil tuzilish sharoitida [1,2] diollar Fetizon reaktivi ishtirokida diketon hosil qilishi mumkin. Shu bilan birga, oksidlovchi uglerod-uglerod bog'lanishining parchalanishi ham sodir bo'lishi mumkin.[18][19]
Ilovalar
Fetizon reaktivi oksidlanishning foydali usuli sifatida topilganidan beri (±) -bukittinggine kabi ko'plab molekulalarning umumiy sintezida ishlatilgan.[20] Fetizon reaktivi turli xil shakar kimyosini o'rganishda, tri va tetra metillangan aldozalarning aldolaktonlarga selektiv oksidlanishiga erishish uchun juda ko'p ishlatilgan,[21] D-ksiloza va L-arabinozaning D-treoz va L-eritrozgacha oksidlanishi,[22] va L-sorbozaning oksidlanishi va boshqalar qatorida L-trerozni ta'minlash.[23]
Adabiyotlar
- ^ a b Fétizon, Marsel; Golfier, Mishel (1968). Comptes Rendus de l'Académie des Sciences, Série C. 267: 900. Yo'qolgan yoki bo'sh
sarlavha =(Yordam bering) - ^ a b Fetizon, M .; Balogh, V .; Golfier, M. (1971). "Kumush karbonat / selit bilan oksidlanishlar. V. Fenollar va unga aloqador birikmalar oksidlanishi". Organik kimyo jurnali. 36 (10): 1339. doi:10.1021 / jo00809a004.
- ^ Parra, M. G. D. L.; Xatchinson, R. R. (1987). "Makrolidlar biosintezi: brefelding C gidroksillanishining stereokimyosi". Antibiotiklar jurnali. 40 (8): 1170–4. doi:10.7164 / antibiotiklar.40.1170. PMID 3680028.
- ^ Tojo, Gabriel (2006) "Fétizon reaktivi: Selitdagi kumush karbonat". Alkogollarning aldegid va ketonlarga oksidlanishi. AQSh: Springer. ISBN 978-0-387-23607-0 doi:10.1007 / 0-387-25725-X_8 281-288 betlar.
- ^ a b v Kakis, F. J .; Fetizon, M .; Duchkin, N .; Golfier, M .; Mourg, P .; Prange, T. (1974). "Alkogollarning selit ustiga kumush karbonat bilan oksidlanishiga oid mexanik tadqiqotlar". Organik kimyo jurnali. 39 (4): 523. doi:10.1021 / jo00918a024.
- ^ a b Ekkert-Makich, M.; Tushek, L .; Sunko, D. E. (1971). Xorvat. Chim. Acta. 43: 79. Yo'qolgan yoki bo'sh
sarlavha =(Yordam bering) - ^ a b Terashima, Shiro; Tanno, Norixiko; Koga, Kenji (1980). "(±) -2-asetil-5,8-dimetoksi-1,2,3,4-tetrahidro-2-naftolning yangi sintezi, antrasiklinonlar sintezi uchun asosiy vosita". Tetraedr Lett. 21 (28): 2749–2752. doi:10.1016 / S0040-4039 (00) 78596-0.
- ^ a b v d Fetizon, M.; Golfier, M .; Louis, J. M. (1969). "Diollarning kumush karbonat bilan yuqori darajada tanlangan oksidlanishlari". Kimyoviy jamiyatning jurnali D: kimyoviy aloqalar (19): 1102. doi:10.1039 / C29690001102.
- ^ Zelle, Robert E.; DeNinno, Maykl P.; Selnik, Garold G.; Danishefskiy, Samuel J. (1986). "Sinkoforinning muntazam ravishda parchalanishi: C₁₇-C₂₅ ramkasining stereoelektiv sintezi". J. Org. Kimyoviy. 51 (25): 5032–5036. doi:10.1021 / jo00375a060.
- ^ Fétizon, Marsel; Golfier, Mishel; Lui, Jan-Mari (1969). "Laktonlarning yangi sintezi: (±) -Mevalonolaktonga qo'llanilishi". J. Chem. Soc. D. (19): 1118–1119. doi:10.1039 / C29690001118.
- ^ Buechi, G .; Vuest, H. (1971). "Non aromati tarkibiy qismi bo'lgan 2-atsetil-1,4,5,6-tetrahidropiridin sintezi". Organik kimyo jurnali. 36 (4): 609. doi:10.1021 / jo00803a030.
- ^ Xuong-Xyu, F.; Herlem, D. (1970). "Alxaloides steroidiques CX (1) - N-demethylation photochimique D'amines tertiaires steroidiques". Tetraedr xatlari. 11 (42): 3649–52. doi:10.1016 / S0040-4039 (01) 98552-1. PMID 5470892.
- ^ Gonikberg, E. M.; Le Noble, W. J. (1995). "5,7-Diazaadamantan-2-one hosilalarining reaktsiyalarida yuzni tanlash: masofaviy o'rinbosarlarning o'zaro ta'siri". Organik kimyo jurnali. 60 (24): 7751. doi:10.1021 / jo00129a014.
- ^ Rok Li, Y .; Kim, B. S .; Il Kweon, H. (2000). "Dihidrofurokinolinonlarni va furokinolinonlarni kumush (I) / Celite tomonidan targ'ib qilingan oksidlovchi siklodiktsiya bilan samarali sintezi". Tetraedr. 56 (24): 3867. doi:10.1016 / S0040-4020 (00) 00307-0.
- ^ Mitchell, Yan S.; Pattenden, Jerald; Stonehouse, Jeffery P. (2002). "Rizoksin D ning qisqacha enantioselektiv total sintezi". Tetraedr Lett. 43 (3): 493–497. doi:10.1016 / S0040-4039 (01) 02154-2.
- ^ Lenz, G. R. (1972). "Fetizon reaktivi tomonidan katalizlangan parchalanish reaktsiyalari (Celite ustidagi kumush karbonat)". Kimyoviy jamiyat jurnali, kimyoviy aloqa (8): 468. doi:10.1039 / C39720000468.
- ^ Fetizon, M .; Golfier, M .; Montaufier, M. T .; Rens, J. (1975). "Rearrangements des halohydrines en mavjudligi de carbonate d'argent sur celite-II". Tetraedr. 31 (8): 987. doi:10.1016/0040-4020(75)80114-1.
- ^ Thuan, M. S. L. T .; Maitte, M. P. (1975). "Oksidlanish selektiv d'A diollari aril-etileniklar va a-ketollar". Tetraedr xatlari. 16 (25): 2027. doi:10.1016 / S0040-4039 (00) 75284-1.
- ^ Thuan, S.-L.-T. (1971). Akad. Sc. Parij. 272: 233. Yo'qolgan yoki bo'sh
sarlavha =(Yordam bering) - ^ Xitkok, C. X.; Stafford, J. A .; Klark, D. L. (1992). "Daphniphyllum alkaloidlari. 14. (±) -bukittingginning umumiy sintezi". Organik kimyo jurnali. 57 (9): 2575. doi:10.1021 / jo00035a011.
- ^ Morgenli, Sveyn; Leander, Kurt; Lüning, Byorn; Fahraeus, Gösta; Lyunggren, Xans; Ehrenberg, L. (1971). "Uglevod hosilalarini kumush karbonat bilan selitda oksidlash. Ba'zi Aldoz metil efirlarini oksidlash". Acta Chem. Skandal. 25: 1154–1155. doi:10.3891 / acta.chem.scand.25-1154.
- ^ Morgenli, Sveyn; Lehto, Anneli; Simov, D .; Øye, H. A .; Svensson, Sigfrid (1972). "Uglevod hosilalarini kumush karbonat bilan selitda oksidlash. III. D-ksiloza va L-arabinozadan tetrozlar hosil bo'lishi". Acta Chem. Skandal. 26: 1709–1710. doi:10.3891 / acta.chem.scand.26-1709.
- ^ Morgenli, Sveyn; Svensson, Sigfrid; Sirt, Leyf J.; Enzell, Kert R.; Svensson, Sigfrid (1972). "Uglevod hosilalarini kumush karbonat bilan selitda oksidlash. IV. L-troseozning alternativ sintezi - L-sorbozaning oksidlanishi". Acta Chem. Skandal. 26: 2146–2147. doi:10.3891 / acta.chem.scand.26-2146.
