Formilatsiya - Formylation
Biokimyoda a qo'shilishi formil funktsional guruhi deb nomlanadi formilatsiya. Formil funktsional guruh vodorod bilan bog'langan karbonildan iborat. An bilan biriktirilganda R guruhi, formil guruhi an deyiladi aldegid.

Formilatsiya bir necha muhim biologik jarayonlarda aniqlangan. Metionin birinchi marta formillanganligi aniqlandi E. coli 1964 yilda Marker va Sanger tomonidan[1] va keyinchalik bakteriyalar va organoidlarda oqsil sintezini boshlashda ishtirok etishi aniqlandi.[2] Shakllanishi N-formilmetionin ferment tomonidan katalizlanadi metionil-tRNKUchrashdi transformilaza.[3] Bundan tashqari, ikkita formillanish reaktsiyasi purinlarning novo biosintezi. Ushbu reaktsiyalar fermentlar tomonidan katalizlanadi glitsinamid ribonukleotid (GAR) transformilaza va 5-aminoimidazol-4-karboksiyamid ribotid (AICAR) transformilaza.[4] Yaqinda formilatsiya a ekanligi aniqlandi histon gen ekspressionini modulyatsiya qilishi mumkin bo'lgan modifikatsiya.
Formilatsiyaning umumiy reaktsiyasi
Formillanish deganda, aralashma formil guruhi (-CH = O) bilan funktsionalizatsiya qilingan har qanday kimyoviy jarayonlarga aytiladi. Organik kimyoda bu atama ko'pincha nisbatan qo'llaniladi aromatik birikmalar (masalan. ning konvertatsiyasi benzol ga benzaldegid ichida Gattermann-Koch reaktsiyasi ). Biyokimyada reaktsiya kabi fermentlar tomonidan katalizlanadi formiltransferazalar.
Biologiyada formillanish reaktsiyalari
Metanogenez
Formilatsiyasi metanofuran boshlanadi metanogenez tsikl Formil guruhi olingan karbonat angidrid va aylantiriladi metan.

Oqsil sintezidagi formillanish

Bakteriyalar va organoidlarda oqsil sintezining boshlanishi hosil bo'lishi bilan signal beradi formil-metionil-tRNK (tRNK)fMet). Ushbu reaktsiya bog'liqdir 10-formiltretrahidrofolat va metionil-tRNA formiltransferaza fermenti.[3]Ushbu reaktsiyadan tKNK borligi sababli ökaryotlar yoki Arxeya foydalanmaydifMet bakterial bo'lmagan hujayralarda intruziv material deb nomlanadi va tezda yo'q qilinadi. Ishlab chiqarilgandan so'ng, tRNKfMet ga etkazib beriladi Ribosomaning 30S subbirligi oqsil sintezini boshlash uchun. fMet metionin bilan bir xil kodon ketma-ketligiga ega. Biroq, fMet faqat oqsil sintezini boshlash uchun ishlatiladi va shu bilan faqat oqsilning N uchida bo'ladi. Qolgan tarjima paytida metionin ishlatiladi. Yilda E. coli, tRNKfMet tomonidan maxsus tan olingan IF-2 boshlang'ich omili, chunki formil guruhi metioninning N-uchida peptid bog'lanish hosil bo'lishini bloklaydi.[3]
Protein sintezi tugagandan so'ng metionin bo'yicha formil guruhini olib tashlash mumkin peptid deformilaza. Metionin qoldig'ini ferment yordamida qo'shimcha ravishda yo'q qilish mumkin metionin aminopeptidaza.

Purin biosintezidagi formillanish reaktsiyalari
Sinovning o'n birinchi bosqichida ikkita formilatsiya reaktsiyasi talab qilinadi inozin monofosfat (IMP), purin ribonukleotidlari AMP va GMP ning kashshofi. Glisinamid ribonukleotid (GAR) transformilaza yo'lning to'rtinchi reaktsiyasida GAR ning formilglisinamidin ribotid (FGAR) ga formatlanishini katalizlaydi. De novo purin biosintezining oldingi bosqichida 5-aminoimidazol-4-karboksiyamid ribotid (AICAR) 5-formaminoimidazol-4-karboksamid ribotid (FAICAR) ga formillanadi. AICAR transformilaza.[4]
GAR transformilaza
PurN GAR transformilaza eukariotlar va prokaryotlarda uchraydi. Biroq, ikkinchi GAR transformilaza, PurT GAR transformilazasi aniqlangan E. coli. Ikki ferment ketma-ket saqlanmasa va turli formil donorlarni talab qilsa, GAR uchun o'ziga xos faollik va Km ham PurT, ham PurN GAR transformilazasida bir xil bo'ladi.
PurN GAR transformilaza
PurN GAR transformilaza 1CDE GAR ning a-amino guruhini formatlash uchun formil donor sifatida N10-formiltetrahidrofolat (N10-formil-THF) koenzimidan foydalanadi. Eukaryotlarda PurN GAR transformilaza katta ko'p funktsiyali oqsilning bir qismidir, ammo prokariotlarda bitta oqsil sifatida topiladi.[6]
Mexanizm

Formilatsiya reaktsiyasi to'g'ridan-to'g'ri uzatish reaktsiyasi orqali amalga oshiriladi, bunda GAR ning amin guruhi tetraedral oraliq hosil qiluvchi N10-formil-THFga nukleofil ta'sir ko'rsatadi.[4] GAR ning a-amino guruhi nisbatan reaktiv bo'lganligi sababli, nukleofilning deprotonatsiyasi erituvchi bilan sodir bo'lishi taklif etiladi. Faol saytda Asn 106, His 108 va Asp 144 formil uzatishda yordam berish uchun joylashtirilgan.[6] Ammo mutagenez tadqiqotlari shuni ko'rsatdiki, bu qoldiqlar kataliz uchun alohida ahamiyatga ega emas, chunki faqat ikki yoki undan ortiq qoldiqlarning mutatsiyalari fermentni inhibe qiladi. Salbiy zaryadlangan Asp144 tuzilishga asoslanib His108 ning pKa-ni ko'paytiradi, deb hisoblashadi, bu esa His108-ning protonlangan imidazolium guruhiga N10-formil-THF formil guruhining elektrofilligini oshiradi. Bundan tashqari, His108 va Asn106 o'tish holatida hosil bo'lgan oksianionni barqarorlashtiradi deb ishoniladi.[7]

PurT GAR transformilaza
PurT GAR transformilazasi formil donor sifatida formatni va kataliz uchun ATPni talab qiladi. PurT GAR transformilazasi 14-50% GAR formillanishlarini amalga oshiradi deb taxmin qilingan E. coli. Ferment oqsillarning ATP-superfamilyasining a'zosi.[8]
Mexanizm
PurT GAR transformilazasi uchun ketma-ket mexanizm taklif qilingan bo'lib, unda qisqa muddatli formil fosfat qidiruv moddasi birinchi shaklga taklif etiladi. Ushbu formil fosfat oraliq moddasi formil guruhini o'tkazish uchun GAR ominining nukleofil ta'siriga uchraydi. Mutagenez tajribalarida formil fosfat oraliq moddasi aniqlandi, unda mutant PurT GAR transforymilaza formatga nisbatan yaqinligi zaif edi.[6] PurT GAR transformilazasini formil fosfat, ADP va GAR bilan inkubatsiya qilish natijasida ham ATP, ham FGAR hosil bo'ladi. Formil fosfatning oraliq bo'lishi mumkinligini ko'rsatadigan yana bir narsa, chunki bu fermentda formillanish reaktsiyasini amalga oshirish uchun kinetik va kimyoviy jihatdan vakolatli.[9] Formilfosfat qidiruv mahsulotidan oldingi ferment fosfat qidiruvi, shuningdek, izotoplarni almashtirish bo'yicha pozitsion tadqiqotlar asosida hosil bo'lish uchun taklif qilingan.[9] Shu bilan birga, strukturaviy ma'lumotlar formatfosfat oralig'ini hosil qilish uchun fermentning faol joyida ATP ning b-fosfatiga to'g'ridan-to'g'ri hujum qilish uchun format joylashishi mumkinligini ko'rsatadi.[8]

AICAR transformilaza
AICAR transformilazasi AICAR-ni FAICAR-ga formatlash uchun formil donor sifatida N10-formiltragidrofolat (N10-formil-THF) koenzimini talab qiladi. Shu bilan birga, AICAR transformilaza va GAR transformilaza yuqori ketma-ket o'xshashlik yoki strukturaviy homologiyaga ega emas.[7]
Mexanizm

AICARdagi elektronlar konjugatsiya orqali delokalizatsiya qilinganligi sababli, AICAR tarkibidagi amin GARdagi o'xshashiga qaraganda ancha kam nukleofillidir. Shuning uchun formillanish reaktsiyasi paydo bo'lishi uchun AIRCAR ning N5 nukleofilini faollashtirish kerak. Histidin 268 va Lizin 267 kataliz uchun muhim ekanligi aniqlandi va barcha AICAR transformilazasida saqlanib qoldi. Histidin 268 AICAR ning N5 nukleofilini deprotonatsiyalashda ishtirok etadi, shu bilan birga Lizin 267 tetraedral oraliqni barqarorlashtirish uchun taklif etiladi.[7]
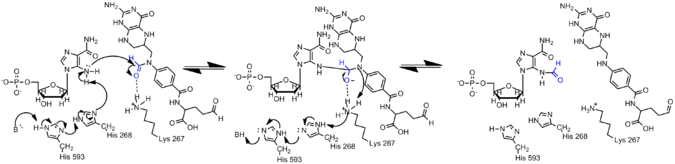
Giston oqsillarida formillanish

ε-Formillanish ko'plardan biridir tarjimadan keyingi modifikatsiyalar modulyatsiyasi ko'rsatilgan histon oqsillarida paydo bo'ladi kromatin konformatsiyalar va genlarni faollashtirish.

Gistonlar va oqsillarda lizin qoldiqlarining Nε-da formillanish aniqlangan. Ushbu o'zgartirish bog'lovchi histonlarda va kuzatilgan yuqori harakatchanlik guruhi oqsillari, u juda ko'p va xromatin funktsiyasining epigenetikasida muhim rol o'ynaydi. Formillangan lizinlar DNKning bog'lanishida rol o'ynashi isbotlangan. Bundan tashqari, giston lizinlarida formillanish aniqlandi, ular atsetilatlangan va metillanganligi ham ma'lum. Shunday qilib, formilatsiya translyatsiyadan keyingi boshqa modifikatsiyani bloklashi mumkin.[10]Formilatsiya eng tez-tez histone H1-ning 19 xil modifikatsiyalash joylarida aniqlanadi. Formilatsiya natijasida hujayraning genetik ifodasi juda buziladi, bu esa saraton kabi kasalliklarga olib kelishi mumkin. Ushbu modifikatsiyalarning rivojlanishi oksidlovchi stress tufayli bo'lishi mumkin.[10]
Giston oqsillarida lizin odatda histon asetil-transferazlar (HAT) va histon deatsetilazalar (HDAC yoki KDAC) tomonidan o'zgartiriladi.Lizin atsetilatsiyasi ba'zi genlarni boshqarilishi va ekspressioni uchun juda muhimdir. Oksidlanish stressi formilfosfat turlarining yuqori reaktivligi tufayli formil-lizin hosil bo'lishi bilan atsetil-lizinni tezda engib o'tadigan sezilarli darajada boshqacha muhit yaratadi. Hozirgi vaqtda bu holat oksidlovchi DNK shikastlanishidan kelib chiqadi, deb hisoblashadi.Formilfosfat hosil bo'lish mexanizmi taklif qilingan bo'lib, u oksidlanib zararlangan DNKga juda bog'liq va asosan hujayra ichidagi radikal kimyo ta'sirida.[11] Keyinchalik ishlab chiqarilgan formilfosfat lizinni formil qilish uchun ishlatilishi mumkin. Oksidlanish stressi oqsillar yuzasida lizin qoldiqlari mavjud bo'lishida va formillanish ehtimoli borligida muhim rol o'ynaydi.

Tibbiyotda formillanish
Formilatsiya reaktsiyalari preparatning maqsadi sifatida
Purin biosintezida ishtirok etadigan fermentlarning inhibatsiyasi kimyoviy terapiya uchun potentsial dori vositasi sifatida ishlatilgan.
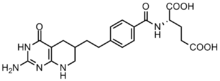
Saraton hujayralari bo'linishni osonlashtirish uchun yuqori konsentratsiyali purinlarni talab qiladi[6] va emas, balki novo sinteziga tayanishga moyil nukleotidlarni qutqarish yo'li.[7][12] GAR transformilaza va AICAR transformilaza tomonidan formillanish reaktsiyalarini inhibe qilish uchun bir necha folat asosidagi inhibitorlar ishlab chiqilgan.[13] Birinchi GAR transformilaza inhibitori Lometreksol [(6R) 5,10-dideazatetrahidrofolat] 1980-yillarda o'zaro hamkorlik orqali ishlab chiqilgan Eli Lilly va akademik laboratoriyalar.[14]
Lometreksol tuzilishi jihatidan N10-formil-THF ga o'xshash bo'lsa-da, bitta uglerod uzatish reaktsiyasini amalga oshirishga qodir emas.[13] Bundan tashqari, GAR transformilazasining bir nechta GAR asosidagi inhibitörleri ham sintez qilingan.[13]Folat asosidagi inhibitörlerin rivojlanishi, ayniqsa, qiyin bo'lganligi aniqlandi, chunki inhibitörler ham fermentni tartibga soladi folipoliglutamat sintaz, fermentga yaqinligi ortishi uchun hujayraga kirgandan so'ng monoglutamat folatlar va antifolatlarga qo'shimcha b-glutamat qo'shadi. Ushbu yaqinlik antifolat qarshiligiga olib kelishi mumkin.[12]
Ley sindromi
Ley sindromi - bu fermentativ formillanish reaktsiyasidagi nuqson bilan bog'liq bo'lgan neyrodejenerativ kasallik. Ley sindromi odatda mitoxondriyada yuzaga keladigan oksidlovchi fosforillanish nuqsonlari bilan bog'liq.[15] Exome ketma-ketligi, Ley sindromi bo'lgan bemorlarda mitoxondriyal metionil-tRNA formiltransferaza (MTFMT) genlarini kodlashda mutatsiyani aniqlash uchun ishlatilgan. Ley sindromining alomatlarini keltirib chiqaradigan MTFMTda aniqlangan c.626C> T mutatsiyasi, ekson birikmasini o'zgartiradi, bu esa mutatsiyaga va muddatidan oldin to'xtash kodoniga olib keladi. MTFMT c.626C> T mutatsiyasiga ega bo'lgan shaxslar fMet-tRNAMet darajasini pasaytirganligi va mitoxondrik tarzda tarjima qilingan COX1 formillanish darajasidagi o'zgarishlarga ega ekanligi aniqlandi. Ushbu havola ma'lum bir mitoxondriyal genlar uchun ekspressionni boshlashda formillangan metionin zarurligi to'g'risida dalillar keltiradi.[16]
Adabiyotlar
- ^ Marker, K; Sanger, F. (1964). "N-formil-metionil-S-RNK". J. Mol. Biol. 8 (6): 835–840. doi:10.1016 / S0022-2836 (64) 80164-9. PMID 14187409.
- ^ Adams, JM .; Capecchi, M.R. (1966). "N-Formilmetionil-sRNA oqsil sintezining tashabbuskori sifatida". PNAS. 55 (1): 147–155. Bibcode:1966 yil PNAS ... 55..147A. doi:10.1073 / pnas.55.1.147. PMC 285768. PMID 5328638.
- ^ a b v Kozak, M (1983). "Prokariotlar, evkaliotlar va organellarda oqsil sintezining boshlanishini taqqoslash". Mikrobiologik sharhlar. 47 (1): 1–45. doi:10.1128 / MMBR.47.1.1-45.1983. PMC 281560. PMID 6343825.
- ^ a b v Voet va Voet (2008). Biokimyo asoslari 3-nashr. Nyu-York: Vili.
- ^ Tauer, R. K. (1998). "Metanogenez biokimyosi: Marjori Stivensonga hurmat". Mikrobiologiya. 144: 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ a b v d Uorren, MS; K.M. Mattia; A.E.Marolevskiy; S.J. Benkovich (1996). "De novo purin biosintezining transformilaza fermentlari" (PDF). Sof Appl. Kimyoviy. 68 (11): 2029–2036. doi:10.1351 / pac199668112029. S2CID 39555269. Olingan 24 fevral 2013.
- ^ a b v d Volan, D; Greasli, SE; Berdsli, P.; Uilson, I.A. (2002). "Qushlarning AICAR transformilaza mexanizmi to'g'risida tizimli tushunchalar". Biokimyo. 41 (52): 15505–15513. doi:10.1021 / bi020505x. PMID 12501179.
- ^ a b Tden, JB .; Firestine, S .; Nikson, A .; Benkovich, S.J .; Holden, XM (2000). "Escherichia coli PurT-kodlangan glitsinamid ribonukleotid transformilaza molekulyar tuzilishi". Biokimyo. 39 (30): 8791–8802. doi:10.1021 / bi000926j. PMID 10913290.
- ^ a b Marolevskiy, A.E .; Mattia, KM .; Uorren, MS; Benkovich, S.J. (1997). "Formil fosfat: Escherichia coli PurT GAR transformilaza tomonidan katalizlanadigan reaktsiyadagi taklif qilingan oraliq mahsulot". Biokimyo. 36 (22): 6709–6716. doi:10.1021 / bi962961p. PMID 9184151.
- ^ a b Vishnevskiy, JR .; Zugman, A .; Mann, M. (2002). "Lizinning N-Formillanishi - bu xromatin funktsiyasini boshqarishda ishtirok etadigan qoldiqlarda paydo bo'ladigan yadro oqsillarining translyatsiyadan keyingi keng tarqalgan modifikatsiyasi". Nuklein kislotalarni tadqiq qilish. 36 (2): 570–577. doi:10.1093 / nar / gkm1057. PMC 2241850. PMID 18056081.
- ^ Tszyan, T; Chjou X.; Tog'izoda, K .; Dong, M.; Dedon, kompyuter. (2007). "Gistron oqsillarida lizinning N-formillanishi oksidlovchi DNK zararlanishidan kelib chiqadigan ikkilamchi modifikatsiya sifatida". PNAS. 104 (1): 60–65. Bibcode:2007 PNAS..104 ... 60J. doi:10.1073 / pnas.0606775103. PMC 1765477. PMID 17190813.
- ^ a b DeMartino, J.K .; Xvan, men.; Xu, L .; Uilson, I.A .; Boger, D.L. (2006). "Glisinamid Ribonukleotid Transformilazasining kuchli, poliglutamatable inhibitori kashf etilishi". Tibbiy kimyo jurnali. 49 (10): 2998–3002. doi:10.1021 / jm0601147. PMC 2531195. PMID 16686541.
- ^ a b v Kristoferson, R.I .; Lyons, S.D .; Uilson, PK (2002). "Preparat sifatida de Novo nukleotid biosintezining ingibitorlari". Acc. Kimyoviy. Res. 35 (11): 961–971. doi:10.1021 / ar0000509. PMID 12437321.
- ^ Vang, L; Desmoulin, S.K .; Cherian, C .; Polin, L .; Oq, K .; Kushner, J .; Fulterer, A .; Chang, M.; Mitchell, S .; Stout, M.; Romero, M.F .; Xou, Z.; Ko'proq, L.H .; Gangji, A (2011). "B-glitsinamid ribonukleotid formiltransferazni inhibe qiluvchi kamaytirilgan folat tashuvchisi ustidan proton bilan bog'langan folat tashuvchisi va folat retseptorlari selektivligi bilan yuqori darajada kuchli 6-o'rnini bosuvchi pirolo [2,3-d] pirimidin tienoyl antifolat inhibitori sintezi, biologik va antitumor faolligi". Tibbiy kimyo jurnali. 54 (20): 7150–7164. doi:10.1021 / jm200739e. PMC 3209708. PMID 21879757.
- ^ "Ley sindromi". Insonda Onlayn Mendelian merosi. Olingan 24 fevral 2013.
- ^ Tucker EJ, Hershman SG, Koxer C, Belcher-Timme CA, Patel J, Goldberger OA, Christodouu J, Silberstein JM, McKenzie M, Ryan MT, Compton AG, Jaffe JD, Carr SA, Calvo SE, RajBhandary UL, Thorburn DR, Mootha VK (2011). "MTFMT mutatsiyalari mitoxondriyali tarjimaning buzilishiga olib keladigan odamda formilatsiyaning buzilishi asosida yotadi". Hujayra Metab. 14 (3): 428–434. doi:10.1016 / j.cmet.2011.07.010. PMC 3486727. PMID 21907147.
