ITIYALAR - ITIES
Yilda elektrokimyo, ITIYALAR (aralashmaydigan ikkita elektrolit eritmasi orasidagi interfeys)[1][2][3] qutblanadigan yoki qutblangan elektrokimyoviy interfeysdir. ITIES o'zgarishi mumkin bo'lsa, polarizatsiyalanadi Galvanining salohiyati farq, yoki boshqacha qilib aytganda, tegishli fazalarning kimyoviy tarkibini sezilarli darajada o'zgartirmasdan (ya'ni interfeysda sodir bo'ladigan sezilarli elektrokimyoviy reaktsiyalarsiz) ikkita qo'shni faza o'rtasidagi ichki potentsialning farqi. ITIES tizimi, agar har xil zaryadlarning taqsimlanishi va oksidlanish-qaytarilish ikki bosqich o'rtasidagi turlar Galvanining potentsial farqini aniqlaydi.
Odatda, bitta elektrolit tarkibidagi suvli elektrolitdir hidrofilik ionlari kabi NaCl suvda erigan va boshqa elektrolitlar a lipofil kabi tuz tetrabutilmonmoniy tetrafenilborat erigan organik erituvchi aralashmaydigan kabi suv bilan nitrobenzol, yoki 1,2-dikloretan.
ITIES ning zaryad uzatish reaktsiyalari
ITIES da zaryad uzatish reaktsiyalarining uchta asosiy sinfini o'rganish mumkin:
- Ion o'tkazuvchanligi reaktsiyalari
- Ion uzatish reaktsiyalari
- Elektronlarning bir xil bo'lmagan o'tkazuvchanlik reaktsiyalari

The Nernst tenglamasi ionlarni o'tkazish reaktsiyasi o'qiladi
- ,
qayerda kuchlanish o'lchovida ifodalangan Gibbs uzatish energiyasi sifatida belgilangan standart uzatish potentsiali.
Yagona heterojen elektronlarni uzatish reaktsiyasi uchun Nernst tenglamasi o'qiladi
- ,
qayerda bu ikki oksidlanish-qaytarilish juftligining standart oksidlanish-qaytarilish potentsiallari farqi sifatida aniqlangan, ammo suvli standart vodorod elektrodiga (SHE) taalluqli bo'lgan elektronlararo uzatish uchun standart oksidlanish-qaytarilish potentsialidir.
To'rt elektrodli hujayra
ITIES ning zaryad uzatish reaktsiyalarini o'rganish uchun to'rt elektrodli xujayradan foydalaniladi.
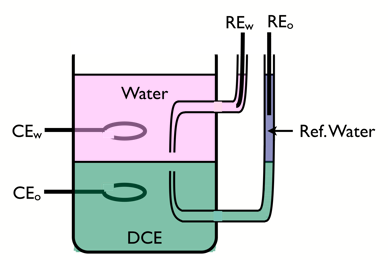
Interfeysning polarizatsiyasini boshqarish uchun ikkita mos yozuvlar elektrodlari va oqimni o'tkazish uchun asil metallardan tayyorlangan ikkita qarshi elektrod ishlatiladi. Suvli quvvatlovchi elektrolit gidrofil, masalan LiCl, organik elektrolit esa tetraheptilammoniy tetra-pentafluorofenil borat kabi lipofil bo'lishi kerak.
Ionning bo'linish koeffitsienti va ionlarning tarqalish koeffitsienti
Neytral eritilgan moddadan farqli o'laroq, ionning bo'linish koeffitsienti ikki faza o'rtasidagi Galvanining potentsial farqiga bog'liq:
Tarqatish salohiyati
Tuz ikki faza o'rtasida taqsimlanganda Galvanining potentsial farqi taqsimot potentsiali deb ataladi va C kationining tegishli Nernst tenglamalaridan olinadi.+ va anion A– o'qish
bu erda γ faoliyat koeffitsienti.
Shuningdek qarang
Adabiyotlar
- ^ Xang, Le Quok (1980-12-23). "Ikki aralashmaydigan elektrolit eritmasi orasidagi interfeysning elektrokimyoviy xususiyatlari: I. qism Muvozanat holati va galvanining potentsial farqi". Elektroanalitik kimyo jurnali. 115 (2): 159–174. doi:10.1016 / S0022-0728 (80) 80323-8. ISSN 0022-0728.
- ^ Hung, Le Quoc (1983-07-08). "Ikki aralashmaydigan elektrolitlar eritmasi orasidagi interfeysning elektrokimyoviy xususiyatlari: III qism. Interfeysdagi galvaniy potentsiali farqi va ikkala fazada o'zaro ta'sir qiluvchi tarkibiy qismlarning taqsimlanishining umumiy holati". Elektroanalitik kimyo jurnali. 149 (1–2): 1–14. doi:10.1016 / S0022-0728 (83) 80553-1. ISSN 0022-0728.
- ^ Samec, Zdenek (1988-06-01). "Ikkala aralashmaydigan elektrolitlar eritmalari orasidagi masofadagi elektr ikki qavatli qatlam". Kimyoviy sharhlar. 88 (4): 617–632. doi:10.1021 / cr00086a003.






![{ displaystyle Delta _ { text {o}} ^ { text {w}} phi _ { text {ET}} ^ { ominus} = left [E _ {{ text {O}} _ {2} / { text {R}} _ {2}} ^ { ominus} right] _ { text {SHE}} ^ { text {o}} - left [E _ {{ text { O}} _ {1} / { text {R}} _ {1}} ^ { ominus} right] _ { text {SHE}} ^ { text {w}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4898078bd6d79795352cb3d42be22314081775a)
![{ displaystyle P_ {i} = { frac {a_ {i} ^ { text {o}}} {a_ {i} ^ { text {w}}}} = exp left [{ frac { z_ {i} F} {RT}} ( Delta _ { text {o}} ^ { text {w}} phi - Delta _ { text {o}} ^ { text {w}} phi _ {i} ^ { ominus}) right] = P_ {i} ^ { ominus} exp left [{ frac {z_ {i} F} {RT}} Delta _ { text {o}} ^ { text {w}} phi right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf1a87afec88692b29566f6d3d7a847bcc8225ba)
