Lanosterol sintazi - Lanosterol synthase
| lanosterol sintaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| EC raqami | 5.4.99.7 | ||||||||
| CAS raqami | 9032-71-7 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Lanosterol sintazi oksidosqualendir siklaza (OSC) ferment o'zgartiradi (S) -2,3-oksidosqualen protosterol kationiga va nihoyat lanosterol.[5] Lanosterol bu to'rtta halqali qidiruv vositadir xolesterin biosintez.[6][7] Odamlarda lanosterol sintazasi LSS tomonidan kodlanadi gen.[8][9]
Yilda eukaryotlar, lanosterol sintazasi an integral monotopik oqsil bilan bog'liq sitosolik tomoni endoplazmatik to'r.[10] Ba'zi dalillar shuni ko'rsatadiki ferment eruvchan,membrana bilan bog'langan oqsil ozida prokaryotlar uni ishlab chiqaradigan.[11]
Fermentning roli tufayli xolesterin biosintez, lanosterol sintaziga qiziqish mavjud inhibitörler mavjudligini to'ldirish uchun, xolesterolni kamaytiradigan potentsial dorilar sifatida statinlar.[12]
Mexanizm
Shunga qaramay, mexanizmga oid ba'zi ma'lumotlar o'z joniga qasd qilish inhibitorlari, mutagenez tadqiqotlar va homologik modellashtirish, qanday qilib hali ham to'liq tushunilmagan ferment hosil bo'lishini katalizlaydi lanosterol.[12]
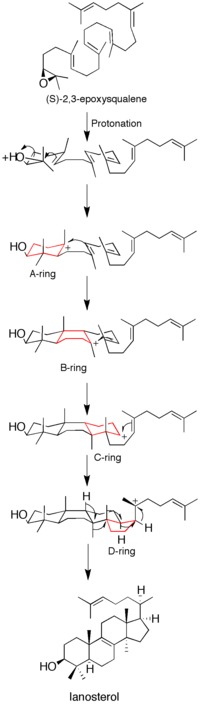
Dastlabki epoksid protonatsiyasi va halqaning ochilishi
Proteinni olishdan oldin X-nurli kristall tuzilishi, saytga yo'naltirilgan mutagenez fermentning katalitik faolligining kalitini aniqlash uchun ishlatilgan. Deb aniqlandi aspartik kislota qoldiq (D455) va ikkitasi histidin qoldiqlar (H146 va H234) fermentlarning ishlashi uchun juda zarur edi. Kori va boshq. aspartik kislota substratlarni protonlash orqali ta'sir qiladi deb faraz qildi epoksid ring, shu bilan uning sezgirligini oshiradi molekula ichi eng yaqin hujum qo'shaloq bog'lanish, H146 orqali aspartik kislotaning proton donorlik qobiliyatini kuchaytirishi mumkin vodorod bilan bog'lanish.[13] Sotib olingandan so'ng X-nurli kristall tuzilishi fermentning D455 ning substrat epoksidiga proton donori sifatidagi o'rni tasdiqlandi, ammo D455 ning ikkitadan vodorod birikmasi bilan barqarorlashishi aniqlandi sistein qoldiqlari (C456 va C533) ilgari tavsiya etilgan histidinga qaraganda.[12]
Halqa hosil qilish kaskadi
Epoksid protonatsiyasi substratni faollashtiradi va halqa hosil qilish reaktsiyalar kaskadini o'rnatadi. Hammasi bo'lib to'rtta halqa hosil bo'ladi (A dan D gacha) xolesterin orqa miya.[12] Ilgari to'rt halqani ham kelishgan shakllanishi g'oyasi ilgari surilgan bo'lsa-da, kinetik tadqiqotlar (S) -2,3-oksidosqualen analoglar mahsulotni shakllantirish diskret orqali amalga oshirilishini ko'rsatdi karbokatsiya oraliq mahsulotlar (qarang Shakl 1). Monosiklik va bisiklik mahsulotlarni lanosterol sintaz mutantlaridan ajratib olish, kelishilgan mexanizm gipotezasini yanada susaytirdi.[14][15] Dalillar shuni ko'rsatadiki, epoksid halqasining ochilishi va halqa shakllanishi kelishilgan.[16]
Tuzilishi
Lanosterol sintaz - ikki domenli monomerik oqsil[10] ikkita bog'langan (a / a) bochka domenlaridan va uchta kichikroqdan iborat b-tuzilmalar. Ferment faol sayt siqilgan kanal bilan yopilgan oqsil markazida joylashgan. Kanal orqali (S) -2,3-epoksissalen substratining o'tishi o'zgarishni talab qiladi oqsil konformatsiyasi. Yilda eukaryotlar, a hidrofob yuzasi (umumiy ferment sirtining 6%) bu ER membranani bog'laydigan mintaqa (qarang Shakl 2).[12]
Ferment tarkibida beshta barmoq izi mintaqasi mavjud Gln -Trp motiflari, ular juda o'xshash bakteriyalar fermenti skvalen-hopen siklazasida ham mavjud.[12] Ushbu barmoq izlari mintaqalarining qoldiqlari tarkibida yuqori darajadagi fermentlarning barqarorligiga hissa qo'shadi deb o'ylangan bir-biriga bog'langan yon zanjirlar mavjud. eksergonik ferment tomonidan katalizlangan siklizatsiya reaktsiyalari.[17]
Funktsiya
Lanosterol hosil bo'lishining katalizi
Lanosterol sintazining konversiyasini katalizlaydi (S) -2,3-epoksisqualen ga lanosterol, to'rtta halqali qidiruv vosita xolesterin biosintez.[6][7] Shunday qilib, u o'z navbatida kashshofni ta'minlaydi estrogenlar, androgenlar, progestogenlar, glyukokortikoidlar, mineralokortikoidlar va neyosteroidlar. Yilda eukaryotlar ferment bilan bog'langan sitosolik tomoni endoplazmatik to'r membrana.[10] Esa xolesterin sintez asosan bog'liqdir eukaryotlar, oz prokaryotlar lanosterol sintazini ifoda etishi aniqlandi; u eruvchan oqsil sifatida topilgan Metilokokk kapsulatus.[11]
Epoksilanosterol hosil bo'lishining katalizi
Lanosterol sintazasi shuningdek 2,3 ning tsikllanishini katalizlaydi; 22,23-diepoksisqualen 24 (S), 25-epoksilanosterol,[18] keyinchalik u 24 (S), 25-epoksixolesterolga aylanadi.[19] Bu soniya uchun ferment yaqinligi sababli substrat monoepoksi (S) -2,3-epoksisqualendan kattaroq, uning qisman inhibisyoni 2,3 ga aylantirilganda; 22,23-diepoksisqualen 24 (S) ga, 25-epoksilanosterolga afzallik beriladi lanosterol sintez.[20] Bu kasallikning oldini olish va davolash uchun dolzarbdir.
Klinik ahamiyati
Xolesterolni kamaytiradigan dorilar sifatida ferment inhibitörleri
Lanosterol sintaz inhibitörlerine qonda xolesterolni kamaytirish va davolash uchun dori sifatida qiziqish ortdi ateroskleroz. Keng tarqalgan statin hozirda tushirish uchun ishlatiladigan dorilar LDL (past zichlikdagi lipoprotein) xolesterin inhibe qilish orqali funktsiya HMG-CoA reduktazasi faoliyat.[6] Chunki bu ferment oqimning yuqori qismida prekursorlar hosil bo'lishini katalizlaydi (S) -2,3-epoksisqualen va xolesterin, statinlar boshqa biosintez yo'llari uchun zarur bo'lgan oraliq moddalarga salbiy ta'sir ko'rsatishi mumkin (masalan, sintezi izoprenoidlar, koenzim Q ). Shunday qilib, xolesterin biosintezi bilan chambarchas bog'liq bo'lgan lanosterol sintaz HMG-CoA reduktazasi, jozibali dori vositasi.[21]
Lanosterol sintaz inhibitörleri kamayadi deb o'ylashadi LDL va VLDL xolesterinni er-xotin nazorat qilish mexanizmi bilan. Lanosterol sintazasi qisman inhibe qilingan tadqiqotlar to'g'ridan-to'g'ri pasayishni ko'rsatdi lanosterol shakllanishi va pasayishi HMG-CoA reduktazasi faoliyat. The oksisterol 24 (S), 25-epoksilanosterol, bu afzalroq shakllangan lanosterol qisman lanosterol sintaz inhibatsiyasi paytida, bu inhibisyon uchun javobgar bo'ladi HMG-CoA reduktazasi faoliyat.[22]
Evolyutsiya
Oksidosqualen siklazlari (OSClar, lanosterol siklaza tegishli bo'lgan sinf) bakteriyalarning skvalen-hopen siklazasidan (SHC) hosil bo'lib, u hosil bo'lishiga bog'liq. hopanoidlar. Filogenetik daraxtlar turli xil organizmlarda OSClarning aminokislotalar ketma-ketligidan tuzilganligi yagona umumiy ajdodni nazarda tutadi va sintez yo'li faqat bir marta rivojlangan.[23] Kashfiyoti steranlar shu jumladan kolestan dan 2,7 milliard yillik slanetslarda Pilbara Kraton, Avstraliya, buni taklif qiladi eukaryotlar OSC va murakkab steroid apparatlari bilan erning boshida mavjud bo'lgan.[24]
Adabiyotlar
- ^ a b v ENSG00000281289 GRCh38: Ensembl relizi 89: ENSG00000160285, ENSG00000281289 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000033105 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ Dekan PD, Ortiz de Montellano PR, Bloch K, Corey EJ (iyun 1967). "Eriydigan 2,3-oksidosqualen sterol siklaza". Biologik kimyo jurnali. 242 (12): 3014–5. PMID 6027261.
- ^ a b v Huff MW, Telford DE (Iyul 2005). "Uzuklar Lordi - oksidosqualenning mexanizmi: lanosterol siklaza kristalli bo'lib qoladi". Farmakologiya fanlari tendentsiyalari. 26 (7): 335–340. doi:10.1016 / j.tips.2005.05.004. PMID 15951028.
- ^ a b Yamamoto S, Lin K, Bloch K (1969 yil may). "Mikrosomal 2,3-oksidosqualen sterol siklazasining ba'zi xususiyatlari". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 63 (1): 110–7. Bibcode:1969 yil PNAS ... 63..110Y. doi:10.1073 / pnas.63.1.110. PMC 534008. PMID 5257956.
- ^ Baker CH, Matsuda SP, Liu DR, Corey EJ (1995 yil avgust). "Jigar cDNA kutubxonasidan lanosterol sintazni kodlovchi inson genini molekulyar klonlash". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 213 (1): 154–160. doi:10.1006 / bbrc.1995.2110. PMID 7639730.
- ^ Yosh, Mishel; Chen, Xayming; Lalioti, Mariya D.; Antonarakis, Stylianos E. (1996 yil may). "Odamning lanosterol sintaz geni 21q22.3 xromosomasiga to'g'ri keladi". Inson genetikasi. 97 (5): 620–624. doi:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- ^ a b v Ruf A, Myuller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (Mar 2004). "Oddiy oksidosqualen siklaza monotopik membrana oqsillari monomer sifatida faoldir". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 315 (2): 247–254. doi:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- ^ a b Lamb DC, Jekson CJ, Warrilow AG, Manning NJ, Kelly DE, Kelly SL (2007 yil avgust). "Metilokokk kapsulatus prokaryotidagi lanosterol biosintezi: sterol biosintezi evolyutsiyasi to'g'risida tushuncha". Molekulyar biologiya va evolyutsiya. 24 (8): 1714–1721. doi:10.1093 / molbev / msm090. PMID 17567593.
- ^ a b v d e f Thoma R, Schulz-Gasch T, D'Arcy B, Benz J, Aebi J, Dehmlow H, Hennig M, Stihle M, Ruf A (2004 yil noyabr). "Odam oksidosqualen siklaza tuzilishidan steroid iskala hosil bo'lishi to'g'risida tushuncha". Tabiat. 432 (7013): 118–122. Bibcode:2004 yil natur.432..118T. doi:10.1038 / tabiat02993. PMID 15525992. S2CID 364281.
- ^ Corey EJ, Cheng CH, Beyker CH, Matsuda SP, Li D, Song X (1997 yil fevral). "Lanosterol sintazining substratni bog'lash segmentlari va katalitik ta'sirini o'rganish. 2, 3-oksidosqualen va saytga yo'naltirilgan mutagenez zondlarining mexanizmi asosidagi analoglaridan olingan karbokatsiyalar bilan yaqinlik yorlig'i". J. Am. Kimyoviy. Soc. 119 (6): 1289–96. doi:10.1021 / ja963228o.
- ^ Vu TK, Vang TT, Chang CH, Liu YT, Shie VS (noyabr 2008). "Saccharomyces cerevisiae oxidosqualene-lanosterol cyclase tirosine 707 qoldig'i stul-qayiq bisiklik halqa hosil bo'lishi va deprotonatsiya reaktsiyalari uchun ahamiyati". Organik xatlar. 10 (21): 4959–62. doi:10.1021 / ol802036c. PMID 18842050.
- ^ Joubert BM, Hua L, Matsuda SP (fevral 2000). "Saccharomyces cerevisiae lanosterol sintazidagi 454 pozitsiyadagi sterik massa B-halqa hosil bo'lishiga ta'sir qiladi, ammo deprotonatsiyaga ta'sir qilmaydi". Organik xatlar. 2 (3): 339–41. doi:10.1021 / ol9912940. PMID 10814317.
- ^ Corey EJ, Cheng CH, Beyker CH, Matsuda SP, Li D, Song X (1997 yil fevral). "Baculovirus ekspression tizimidan foydalangan holda sof rekombinant S. cerevisiae Lanosterol sintazini tayyorlash metodikasi. Lanosterolning 2,3-oksidosqualendan biosintezida oksiran parchalanishi va A-halqa hosil bo'lishi haqida dalillar". J. Am. Kimyoviy. Soc. 119 (6): 1277–88. doi:10.1021 / ja963227w.
- ^ Vendt KU, Poralla K, Schulz GE (1997 yil sentyabr). "Skvalen siklaza tuzilishi va funktsiyasi". Ilm-fan. 277 (5333): 1811–15. doi:10.1126 / science.277.5333.1811. PMID 9295270.
- ^ Corey EJ, Gross SK (1967 yil avgust). "2,3-oksidosqualene-sterol siklaza ta'sirida 2,3: 22,23-dioksidosqualen va 2,3-oksido-22,23-dihidrosqualen substratlariga sterollar hosil bo'lishi". Amerika Kimyo Jamiyati jurnali. 89 (17): 4561–2. doi:10.1021 / ja00993a079. PMID 6046552.
- ^ Nelson JA, Steckbek SR, Spenser TA (Fevral 1981). "24,25-epoksixolesterolning skvalen 2,3; 22,23-dioksiddan biosintezi". Biologik kimyo jurnali. 256 (3): 1067–8. PMID 7451488.
- ^ Butaud O, Dolis D, Shuber F (oktyabr 1992). "2,3 (S): 22 (S), 23-dioksidosqualenni sutemizuvchilar 2,3-oksidosqualen-lanosterol siklaza tomonidan imtiyozli siklizatsiyasi". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 188 (2): 898–904. doi:10.1016 / 0006-291X (92) 91140-L. PMID 1445330.
- ^ Telford DE, Lipson SM, Barret PH, Sutherland BG, Edvards JY, Aebi JD, Dehmlow H, Morand OH, Huff MW (Dekabr 2005). "Oksidosqualenning yangi inhibitori: lanosterol siklaza juda past zichlikdagi lipoprotein apolipoprotein B100 (apoB100) ishlab chiqarishni inhibe qiladi va past zichlikdagi lipoprotein apoB100 katabolizmini jigar xolesterin miqdorini sezilarli darajada pasayishi orqali kuchaytiradi". Arterioskleroz, tromboz va qon tomir biologiyasi. 25 (12): 2608–14. doi:10.1161 / 01.ATV.0000189158.28455.94. PMID 16210564.
- ^ Panini SR, Gupta A, Sexton RC, Parish EJ, Rudney H (oktyabr 1987). "Sterol biosintezi va 3-gidroksi-3-metilglutaril-koenzim A progesteron bilan o'stirilgan hujayralardagi reduktaza faolligini tartibga solish". Biologik kimyo jurnali. 262 (30): 14435–40. PMID 3667583.
- ^ Pearson A, Budin M, Brocks JJ (2003 yil dekabr). "Gemmata obscuriglobus bakteriyasida sterol sintezining filogenetik va biokimyoviy dalillari". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 100 (26): 15352–7. Bibcode:2003 PNAS..10015352P. doi:10.1073 / pnas.2536559100. PMC 307571. PMID 14660793.
- ^ Broklar JJ, Logan GA, Buik R, Summons RE (avgust 1999). "Arxey molekulyar qoldiqlari va eukaryotlarning erta ko'tarilishi". Ilm-fan. 285 (5430): 1033–6. CiteSeerX 10.1.1.516.9123. doi:10.1126 / science.285.5430.1033. PMID 10446042.
Qo'shimcha o'qish
- Roessler E, Mittaz L, Du Y, Skott XS, Chang J, Rossier S, Gipponi M, Matsuda SP, Muenke M, Antonarakis SE (noyabr 1999). "Odamning Lanosterol sintaz genining tuzilishi va uni holoprosensefali (HPE1) uchun nomzod sifatida tahlil qilish". Inson genetikasi. 105 (5): 489–95. doi:10.1007 / s004390051135. PMID 10598817.
- Ma J, Dempsey AA, Stamatiou D, Marshall KW, Liew CC (Mar 2007). "Odam sub'ektlarida plazmadagi lipid darajasi bilan bog'liq bo'lgan leykotsitlar genlarini ekspression shakllarini aniqlash". Ateroskleroz. 191 (1): 63–72. doi:10.1016 / j.ateroskleroz.2006.05.032. PMID 16806233.
- Beyea MM, Heslop CL, Sawyez CG, Edvards JY, Markle JG, Hegele RA, Huff MW (2007 yil fevral). "LXR-regulyatsiya qilingan ABCA1, ABCG1 va APOE genlarini makrofaglarda tanlab up-regulyatsiyasi 24 (S), 25-epoksixolesterinning endogen sintezi orqali". Biologik kimyo jurnali. 282 (8): 5207–16. doi:10.1074 / jbc.M611063200. PMID 17186944.
- Dang H, Liu Y, Pang Vt, Li C, Vang N, Shyy JY, Zhu Y (Mar 2009). "2,3-oksidosqualen siklazani yuqori yog'li diet bilan bostirish jigar X retseptorlari-alfa vositasida jigar lipid profilini yaxshilashga yordam beradi". Biologik kimyo jurnali. 284 (10): 6218–26. doi:10.1074 / jbc.M803702200. PMC 2649084. PMID 19119143.
- Kimura K, Vakamatsu A, Suzuki Y, Ota T, Nishikava T, Yamashita R, Yamamoto J, Sekine M, Tsuritani K, Vakaguri H, Ishii S, Sugiyama T, Saito K, Isono Y, Iri R, Kushida N, Yoneyama T , Otsuka R, Kanda K, Yokoi T, Kondo H, Vagatsuma M, Murakava K, Ishida S, Ishibashi T, Takaxashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (Yanvar 2006) ). "Transkripsiya modulyatsiyasining diversifikatsiyasi: keng ko'lamli identifikatsiyalash va inson genlarining muqobil alternativ targ'ibotchilarini tavsiflash". Genom tadqiqotlari. 16 (1): 55–65. doi:10.1101 / gr.4039406. PMC 1356129. PMID 16344560.
- Sung CK, Shibuya M, Sankawa U, Ebizuka Y (oktyabr 1995). "Odamning lanosterol sintazini kodlovchi cDNA ning molekulyar klonlashi". Biologik va farmatsevtika byulleteni. 18 (10): 1459–61. doi:10.1248 / bpb.18.1459. PMID 8593458.
- Young M, Chen H, Lalioti MD, Antonarakis SE (may 1996). "Odamning lanosterol sintaz geni 21q22.3 xromosomasiga to'g'ri keladi". Inson genetikasi. 97 (5): 620–4. doi:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- Peffley DM, Gayen AK, Morand OH (1998 yil avgust). "3-gidroksi-3-metilglutaril koenzimining reduktaza mRNK darajasining pastga tushishi va oksidosqualen siklaza inhibitori [4 '- (6-allil-etil-amino-heksiloksi) -2'-ftor- tomonidan siriyalik hamster C100 hujayralarida sintezi. fenil] - (4-bromofenil) -me thanone (Ro 48-8071): simvastatin bilan taqqoslash ". Biokimyoviy farmakologiya. 56 (4): 439–49. doi:10.1016 / S0006-2952 (98) 00083-5. PMID 9763219.
- Lu Y, Dollé ME, Imholz S, van R Slot, Verschuren WM, Wijmenga C, Feskens EJ, Boer JM (Dekabr 2008). "Nomzodlarning yo'llari bo'yicha bir nechta genetik variantlar plazmadagi yuqori zichlikdagi lipoprotein xolesterin konsentratsiyasiga ta'sir qiladi". Lipid tadqiqotlari jurnali. 49 (12): 2582–9. doi:10.1194 / jlr.M800232-JLR200. PMID 18660489.
- Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S, Patel S, Long J, Stern D, Tammana H, Helt G, Sementchenko V, Pikcolboni A, Bekiranov S, Beyli DK, Ganesh M, Ghosh S, Bell I , Gerhard DS, Gingeras TR (2005 yil may). "5 ta nukleotid rezolyusiyasida odamning 10 ta xromosomasining transkripsiyaviy xaritalari". Ilm-fan. 308 (5725): 1149–54. Bibcode:2005 yil ... 308.1149C. doi:10.1126 / science.1108625. PMID 15790807. S2CID 13047538.
- Pyrah IT, Kalinovskiy A, Jekson D, Devis V, Devis S, Aldrij A, Grivz P (2001). "It va sichqonchada oksidosqualen siklaza ikki bog'liq inhibitorlari bilan bog'liq toksikologik shikastlanishlar". Toksikologik patologiya. 29 (2): 174–9. doi:10.1080/019262301317052440. PMID 11421484. S2CID 38721319.
- Bonaldo MF, Lennon G, Soares MB (1996 yil sentyabr). "Normallashtirish va ayirish: genlarni kashf etishni osonlashtirish uchun ikkita yondashuv". Genom tadqiqotlari. 6 (9): 791–806. doi:10.1101 / gr.6.9.791. PMID 8889548.
- Ruf A, Myuller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (Mar 2004). "Oddiy oksidosqualen siklaza monotopik membrana oqsillari monomer sifatida faoldir". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 315 (2): 247–54. doi:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- Mark M, Myuller P, Mayer R, Eyzel B (Yanvar 1996). "Yangi 2,3-oksidosqualen siklaza inhibitori HepG2 hujayralarida xolesterin biosintezini boshqarishga ta'siri". Lipid tadqiqotlari jurnali. 37 (1): 148–58. PMID 8820110.
Tashqi havolalar
- Lanosterol + sintaz AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)