Mad1 - Mad1 - Wikipedia
| Mad1 | |||||||
|---|---|---|---|---|---|---|---|
 Kristal tuzilishi, Mad1-Mad2 kompleksining tetrameri, sariq va qizil = Mad1 monomerlari, och yashil = Mad2 monomerlari | |||||||
| Identifikatorlar | |||||||
| Organizm | |||||||
| Belgilar | MAD1 | ||||||
| Entrez | 852794 | ||||||
| PDB | 1GO4 | ||||||
| RefSeq (mRNA) | NM_001180951.3 | ||||||
| RefSeq (Prot) | NP_011429.3 | ||||||
| UniProt | P40957 | ||||||
| Boshqa ma'lumotlar | |||||||
| Xromosoma | VII: 0,35 - 0,35 Mb | ||||||
| |||||||
Mad1 muhim emas oqsil qaysi ichida xamirturush ning funktsiyasiga ega milni yig'ish punkti (SAC).[1]Ushbu nazorat punkti shpindel mikrotubulalariga xromosomalarning birikishini nazorat qiladi va shpindel hosil bo'lguncha hujayralarni anafazani boshlashiga yo'l qo'ymaydi. Mad nomi mikrotubulalar depolimerizatsiyasi jarayonida mutant hujayralar mitoz tutilish etishmovchiligi (MAD) ekanligini kuzatishni anglatadi. Mad1 anafaz inhibitori bilan ishlaydi Mad2 biriktirilmagan kinetoxorlarga va Mad2- uchun juda zarurCD20 murakkab shakllanish jonli ravishda lekin emas in vitro. In Vivo jonli ravishda, Mad1 Mad2-Cdc20 kompleksining raqobatdosh inhibitori vazifasini bajaradi.[2] Mad1 Mps1 tomonidan fosforillanadi va keyinchalik boshqa tadbirlar bilan birgalikda mitotik nazorat punkti kompleksini (MCC) hosil bo'lishiga olib keladi. Shu bilan u anafazani rivojlantiruvchi kompleks / siklosoma (APC / C) faolligini inhibe qiladi. Mad1 gomologlari eukaryotlarda xamirturushdan sutemizuvchilargacha saqlanadi.
Kirish
90-yillarning boshlarida xamirturush genlari aniqlandi, bu mutatsiyalar mikrotubulani demontaj qilishga javoban mitoz tutilishida nuqsonga olib keldi (mitoz hibsga etishmayotgan genlar - MAD genlari). Ushbu hujayralar mikrotubulali polimerizatsiya inhibitörleri ishtirokida mitotik to'xtashni ko'rsatmadi va shuning uchun hujayra bo'linishini kechiktirishga qodir emas edi.[1] Aniqlangan genlarga quyidagilar kiradi MAD1, MAD2 va MAD3 genlar. Ular hamma narsada saqlanib qolgan eukaryotlar va faol bo'lgan yo'lda ishtirok etadilar prometafaza opaning muddatidan oldin ajralishini oldini olish uchun xromatidlar va deb nomlanganlarni tashkil qiladi milni yig'ish punkti (SAC). Ushbu nazorat punkti xromosomalarning mitotik shpindelga bog'lanish holatini nazorat qiladi va inhibe qiladi metafaza ga anafaza aktivatsiyasini oldini olish orqali o'tish anafazani rivojlantiruvchi kompleks / siklosoma (APC / C) va shu bilan tanazzul ning hujayra aylanishi regulyatorlar.[3] Mad1 biriktirilmagan kinetoxorlarda to'plangan ushbu yo'lda va ushbu uskunadagi biriktirilmagan kinetoxorlar uchun sensor vazifasini bajaradi.
Funktsiya
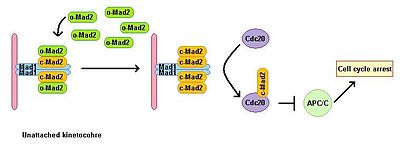
Eukaryotik hujayralar mikrotubulalar polimerizatsiyasi inhibitörleri ishtirokida mitotik to'xtatilishini ko'rsatadi. Shpindelni yig'ish punkti shpindelning holatini nazorat qiladi va metafaza-anafazaga o'tishni barcha kinetoxorlarni mitotik shpindelga to'g'ri bipolyar biriktirishga bog'laydi. Shpindelni yig'ish punkti anafaza boshlanishiga va mitozdan chiqishga olib keladigan quyi oqim effektorlarining degradatsiyasini oldini olish orqali anafazani rivojlantiruvchi kompleksning faoliyatini inhibe qiladi. Mad1 ning tükenmesi yo'qotishga olib keladi SAC funktsiya. Mad1 asosan biriktirilmagan kinetoxorlarda lokalizatsiyalanadi va bitta biriktirilmagan kinetoxor holatida mitoz tutilishini keltirib chiqaradi. Mad1 muhim SAC komponentini jalb qiladi Mad2 biriktirilmagan kinetoxorlarga va mitoz to'xtatish signalining kuchayishiga olib keladi. Uning faol bo'lmagan ochiq konformatsiyasida o-MAD2 deb nomlangan erkin sitoplazmatik Mad2 havzasi mavjud. Mad1 bilan bog'langanda, Mad2 faolni qabul qiladi konformatsiya yopiq (c-Mad2) deb nomlanadi va ikkita Mad1 va ikkita c-Mad2 birliklarining heterotetramerini hosil qiladi. Mad1-c-Mad2 heterotetrameri juda barqaror va a sifatida ishlaydi katalitik retseptorlari bepul sitoplazmik o-Mad2 uchun. Erkin o-Mad2 ushbu retseptor bilan bog'lanib, konformatsiyasini faol yopiq shaklga o'zgartiradi. Ushbu ikkinchi c-MAD2 ga o'tkaziladi CD20 hali noma'lum mexanizmga ega va Cdc20-c-Mad2 kompleksini hosil qiladi. Ushbu kompleks mitotik nazorat punktlari kompleksining (MCC) muhim tarkibiy qismidir. MCC bog'laydi va inhibe qiladi APC / C va shuning uchun mitoz orqali rivojlanishni to'xtatadi.[3][4]
Tartibga solish
Yuqori oqimdagi ikkita nazorat punkti mavjud kinazlar orqali Mad1 funktsiyasini tartibga solishda ishtirok etadi fosforillanish.[5] Mps1 Mad1 ni ham fosforilatlaydi in vitro va jonli ravishda va Mad1 va Mad2 lokalizatsiyasini tartibga soladi deb o'ylashadi kinetoxoralar va ularning o'zaro ta'sir dinamikasi. BUB1 Mad1ni kinetoxorlarga jalb qiladigan va kinetoxora biriktirilmagan bo'lsa, uni faollashtiradigan boshqa kinazdir.[3]Agar milga kinetoxor biriktirilgan bo'lsa, S31 inhibitori p31kometa Mad1 ning Med2 konformatsion qayta tuzilishini inhibe qiladi va Mad2 ning Cdc20 bilan bog'lanishiga yo'l qo'ymaydi.[3]
Tuzilish xususiyatlari va mexanizmi

Biokimyoviy usullar bilan Mad1 90kD, 718-qoldiqni,[6] o'ralgan lasan oqsil xarakterli novda shakli bilan[1]1995 yilda Kristalli konstruktsiyalar tez orada paydo bo'ldi. Keyinchalik 2002 yilda tetramer hosil qiluvchi inson Mad2 bilan kompleksdagi insonning Mad1 kristalli tuzilishi nashr etildi. Eksperimental cheklovlar tufayli strukturada faqat Mad1 qoldiqlari 484 - 584 ko'rsatilgan. Uzaygan Mad1 monomerlari N-terminal alfa spirallarini o'z ichiga olgan parallel o'ralgan spiral bilan mahkam o'rnashgan. Mad1 zanjirlari o'ralgan spiraldan Mad2 ligandlariga qarab Mad2 bilan ikkita kichik kompleks hosil qiladi. Alfa spirallar 1 va 2 orasidagi segment Mad2 majburiy domenini o'z ichiga oladi. Ushbu majburiy domenning birinchi qismi moslashuvchan va assimetrik kompleksni keltirib chiqaradigan turli xil konformatsiyalarni qabul qiladi. Termodinamik tadqiqotlar olib borgan ishlarida Sironi va boshq.[2]Mad1 funktsiyalari, masalan, Mad2- tezligini sekinlashtirishCD20 murakkab shakllanish va shuning uchun raqobatdosh inhibitor vazifasini bajaradi jonli ravishda. Bundan tashqari, mualliflarning fikriga ko'ra, Mad1-Mad2 bog'lash joylari strukturaning ichiga ko'milgan bo'lishi mumkin, ehtimol bog'lanish joylarini Cdc20 bilan bog'lab bo'lmaydi. Mad1-Mad2 bog'lashi odatiy emas, chunki Mad2 C-terminali Mad1 ustiga burishadi. Shuning uchun mualliflar, bezovtalanmagan Mad1-Mad2 kompleksi konformatsion o'zgarish mexanizmini, hozircha yaxshi tushunilmagan romanni talab qiladigan Mad2 ni chiqarmaydi degan xulosaga kelishdi.[2]
Saraton
Meyoz paytida xromosoma sonidagi nomuvofiqliklar (aneuploidiyalar) Daun sindromi kabi odam kasalliklari uchun javobgardir va saraton hujayralarida tez-tez paydo bo'lib turadi. SACning muhim funktsiyasi SAC mutatsiyalari va ayniqsa SACning inaktivatsiyasi shish paydo bo'lishiga sabab bo'lishi yoki hech bo'lmaganda o'simogenezni engillashtirishi mumkin degan farazni keltirib chiqaradi.[3] Ushbu g'oyaga qarshi, SAC tarkibiy qismlari mavjud bo'lmaganda, saraton hujayralari apoptozga uchraganligi ko'rsatildi.[7] Ushbu modelda, boshqa modeldan farqli o'laroq, SAC inaktivatsiyasi tez bo'linadigan saraton hujayralarini yo'q qilishning potentsial usuliga aylanadi. Mad1p, SAC, apoptoz va saraton o'rtasidagi molekulyar aloqalar hali ham to'liq tushunilmagan.[3]
Shuningdek qarang
Adabiyotlar
- ^ a b v Hardwick KG, Murray AW (1995). "Mad1p, yangi paydo bo'lgan xamirturushdagi milni yig'ish punktining fosfoprotein komponenti". Hujayra biologiyasi jurnali. 131 (3): 709–720. doi:10.1083 / jcb.131.3.709. PMC 2120625. PMID 7593191.
- ^ a b v Sironi L, Mapelli M, Knapp S, De Antoni A, Jeang KT, Musacchio A (2002). "Mad1-Mad2 tetramerik yadro kompleksining kristalli tuzilishi: milni nazorat qilish punkti uchun" xavfsizlik kamarini "bog'lash mexanizmining natijalari". EMBO jurnali. 21 (10): 2496–2506. doi:10.1093 / emboj / 21.10.2496. PMC 126000. PMID 12006501.
- ^ a b v d e f Musacchio A, Salmon ED (may 2007). "Shpindelni yig'ish punkti vaqt va makonda". Nat. Rev. Mol. Hujayra biol. 8 (5): 379–93. doi:10.1038 / nrm2163. PMID 17426725. S2CID 205494124.
- ^ Yu H (2006 yil aprel). "Mitotik shpindel nazorat punktida Mad2 ning strukturaviy faollashuvi: Mad2 shablon modeli bilan ikki holatli Mad2 modeli". J. Hujayra Biol. 173 (2): 153–157. doi:10.1083 / jcb.200601172. PMC 2063805. PMID 16636141.
- ^ Bharadvaj R, Yu H (2000). "Milni tekshirish punkti, aneuploidiya va saraton". Onkogen. 23 (11): 2016–27. doi:10.1038 / sj.onc.1207374. PMID 15021889.
- ^ Chen RH, Shevchenko A, Mann M, Murray AW (1998). "Spindle Checkpoint Protein Xmad1 Xmad2 ni biriktirilmagan kinetoxorlarga jalb qiladi". Hujayra biologiyasi jurnali. 143 (2): 283–295. doi:10.1083 / jcb.143.2.283. PMC 2132829. PMID 9786942.
- ^ Kops GJ, Foltz DR, Klivlend DW (iyun 2004). "Mitoz tekshiruv punktini inhibe qilish orqali xromosomalarning katta yo'qotilishi natijasida inson saraton hujayralariga o'lim". Proc. Natl. Akad. Ilmiy ish. AQSH. 101 (23): 8699–704. Bibcode:2004 yil PNAS..101.8699K. doi:10.1073 / pnas.0401142101. PMC 423258. PMID 15159543.
