P4HB - P4HB
Oqsil disulfid-izomeraza, shuningdek, beta-subbirlik ning prolil 4-gidroksilaza (P4HB), an ferment tomonidan kodlangan odamlarda P4HB gen. Inson P4HB gen 17q25 xromosomasida lokalize qilingan.[5][6][7][8] Boshqa prolil 4-gidroksilaza oilaviy oqsillaridan farqli o'laroq, bu protein ko'p funktsiyali va an vazifasini bajaradi oksidoreduktaza uchun disulfid shakllanishi, sinishi va izomerizatsiya.[9] P4HB faoliyati qat'iy tartibga solingan. Ikkala dimerning ajralishi va substratning bog'lanishi kataliz jarayonida uning fermentativ faolligini kuchaytirishi mumkin.[10][11]
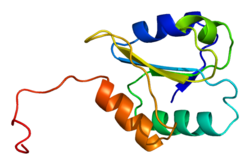
Tuzilishi
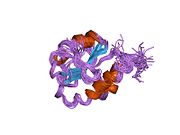
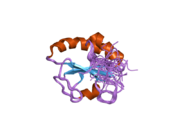
P4HB to'rtta tioredoksin domenlari (a, b, b 'va a'), ikkita CGHC bilan faol saytlar a va a ’domenlarida. Ham kamaytirilgan, ham oksidlangan holatda bu domenlar taqa shaklida joylashtirilgan. Kamaytirilgan P4HB da a, b va b 'domenlari bir tekislikda, a' -45 ° burchak ostida buriladi. Oksidlanganda to'rtta domen bir tekislikda qoladi va faol joylar orasidagi masofa kamaytirilgan holatdagidan kattaroqdir. Oksidlangan shakl ham ko'proq ta'sir qiladi hidrofob va substratni bog'lashni osonlashtiradigan katta yoriqqa ega.[12][13] P4HB ning in vivo jonli ravishda katalitik bo'lmagan bb 'domenlari orqali dimerlashi ko'rsatilgan. Dimer bloklari substrat bilan bog'lanish joyini hosil qiladi va P4HB faolligini inhibe qiladi.[14]
Funktsiya
Ushbu gen oqsil disulfid izomeraza turkumiga kiruvchi juda ko'p funktsional ferment bo'lgan prolil 4-gidroksilaza beta birligini kodlaydi. Ikki alfa va ikkita beta subbirligidan tashkil topgan tetramer sifatida mavjud bo'lganda, bu ferment preprokollagendagi prolil qoldiqlarini gidroksillashtirishda ishtirok etadi. Ushbu ferment, shuningdek, disulfid bog'lanishining hosil bo'lishini, sinishini va qayta tashkil qilinishini katalizlaydigan ikkita tioredoksin domenini o'z ichiga olgan disulfid izomerazidir. Boshqa ma'lum funktsiyalarga, uni inhibe qiluvchi chaperone sifatida harakat qilish qobiliyati kiradi birlashma kontsentratsiyaga bog'liq holda noto'g'ri katlanmış oqsillarning, uning bog'lanish qobiliyatining qalqonsimon bez gormoni, oqimining kirib kelishida ham, oqimida ham uning roli S-nitrosotiol - bog'langan azot oksidi, va uning mikrosomalning subbirniti vazifasi triglitseridlarni uzatish oqsili murakkab.[6]
Klinik ahamiyati
P4HB - bu xavf omili ning amiotrofik lateral skleroz (ALS). Tadqiqotlar P4HB tarkibidagi ikkita SNP uchun FALS (oilaviy ALS), rs876016 (P = 0.0198) va rs2070872 (P = 0.0046) bilan bog'liq bo'lgan muhim genotipik birlashmalarni ko'rsatdi. Boshqalar bilan birgalikda ER stress markerlari, P4HB ALS orqa miyasida juda ko'tarilgan.[15] P4HB nitrosillangan bo'lishi mumkin va nitrosillangan P4HB balandligi ko'rsatilgan Parkinson va Altsgeymer miya to'qimalari kasalligi, shuningdek transgen mutantda superoksid dismutaz 1 sichqoncha va odamning sporadik amiotrofik lateral sklerozi orqa miya to'qimalari.[16][17] Ga qo'shimcha sifatida neyrodejenerativ kasalliklar, P4HB darajasi yangilangan glioblastoma multiforme (GBM) (miya shishi). P4HB inhibisyonu qarshilikni susaytiradi temozolomid, standart GBM kimyoviy terapevtik agent, endoplazmik retikulumning stressga javob berish yo'lining PERK qo'li orqali.[18] Bundan tashqari, heterozigot missense P4HB mutatsiyasiga olib kelishi mumkin Koul-Karpenter sindromi, og'ir suyak mo'rtligi buzilishi.[19]
O'zaro aloqalar
P4HB ko'rsatildi o'zaro ta'sir qilish bilan UBQLN1,[20] ERO1LB[21][22] va ERO1L.[21][22]
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000185624 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000025130 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ Shoulders CC, Brett DJ, Bayliss JD, Narcisi TM, Jarmuz A, Grantham TT, Leoni PR, Bhattacharya S, Pease RJ, Cullen PM (dekabr 1993). "Abetalipoproteinemiya, mikrosomal triglitseridlarni uzatuvchi oqsilning 97 kDa subbirligini kodlovchi gen nuqsonlaridan kelib chiqadi". Inson molekulyar genetikasi. 2 (12): 2109–16. doi:10.1093 / hmg / 2.12.2109. PMID 8111381.
- ^ a b "Entrez Gen: P4HB prokollagen-prolin, 2-oksoglutarat 4-dioksigenaza (prolin 4-gidroksilaza), beta polipeptid".
- ^ Galligan JJ, Petersen DR (iyul 2012). "Inson oqsillari disulfid izomeraza genlari oilasi". Inson genomikasi. 6: 6. doi:10.1186/1479-7364-6-6. PMC 3500226. PMID 23245351.
- ^ Pajunen L, Jons TA, Goddard A, Sheer D, Sulaymon E, Pihlajaniemi T, Kivirikko KI (1991-01-01). "Prolin 4-gidroksilaza va ferment oqsil disulfid izomerazasining beta-bo'linmasi vazifasini bajaruvchi ko'p funktsiyali polipeptid (P4HB) uchun inson genini kodlashning mintaqaviy tayinlanishi 17q25". Sitogenetika va hujayra genetikasi. 56 (3–4): 165–8. doi:10.1159/000133078. PMID 1647289.
- ^ Lumb RA, Bulleid NJ (dekabr 2002). "Protein disulfid izomerazasi oksidlanish-qaytarilishga bog'liq molekulyar chaperonmi?". EMBO jurnali. 21 (24): 6763–70. doi:10.1093 / emboj / cdf685. PMC 139105. PMID 12485997.
- ^ Bastos-Aristizabal S, Kozlov G, Gehring K (may 2014). "Inson oqsillari disulfid izomerazasining dimerizatsiyasi to'g'risida tizimli tushuncha". Proteinli fan. 23 (5): 618–26. doi:10.1002 / pro.2444. PMC 4005713. PMID 24549644.
- ^ Winter J, Klappa P, Freedman RB, Lilie H, Rudolph R (yanvar 2002). "Proinsulinni samarali ravishda qaytarish uchun odam oqsil-disulfid izomerazasining katalitik faolligi va shaperon funktsiyasi zarur". Biologik kimyo jurnali. 277 (1): 310–7. doi:10.1074 / jbc.M107832200. PMID 11694508.
- ^ Tian G, Xiang S, Noiva R, Lennarz VJ, Shindelin H (2006 yil yanvar). "Xamirturushli oqsil disulfid izomerazasining kristalli tuzilishi uning faol joylari o'rtasida kooperativlikni taklif qiladi". Hujayra. 124 (1): 61–73. doi:10.1016 / j.cell.2005.10.044. PMID 16413482. S2CID 17684326.
- ^ Vang S, Li V, Ren J, Fang J, Ke X, Gong V, Feng V, Vang CC (iyul 2013). "Odam oqsillari disulfid izomerazasining oksidlanish-qaytarilish bilan boshqariladigan dinamik konformatsiyalari bo'yicha tarkibiy tushunchalar". Antioksidantlar va oksidlanish-qaytarilish signallari. 19 (1): 36–45. doi:10.1089 / ars.2012.4630. PMID 22657537.
- ^ Bastos-Aristizabal S, Kozlov G, Gehring K (may, 2014). "Inson oqsillari disulfid izomerazasining dimerizatsiyasi to'g'risida tizimli tushuncha". Proteinli fan. 23 (5): 618–26. doi:10.1002 / pro.2444. PMC 4005713. PMID 24549644.
- ^ Atkin JD, Farg MA, Walker AK, McLean C, Tomas D, Horne MK (iyun 2008). "Endoplazmatik retikulum stressi va odamning sporadik amyotrofik lateral sklerozida buklanmagan oqsil reaktsiyasini induktsiyasi". Kasallikning neyrobiologiyasi. 30 (3): 400–7. doi:10.1016 / j.nbd.2008.02.009. PMID 18440237. S2CID 44252514.
- ^ Walker AK, Farg MA, Bye CR, McLean CA, Horne MK, Atkin JD (yanvar 2010). "Disulfidli oqsil izomerazasi oqsillarni birikishidan himoya qiladi va lateral amiotrofik sklerozda S-nitrosillanadi". Miya. 133 (Pt 1): 105-16. doi:10.1093 / brain / awp267. PMID 19903735.
- ^ Uehara T, Nakamura T, Yao D, Shi ZQ, Gu Z, Ma Y, Masliah E, Nomura Y, Lipton SA (may 2006). "S-nitrosillangan oqsil-disulfid izomerazasi oqsilning noto'g'ri birikishini neyrodejeneratsiyaga bog'laydi". Tabiat. 441 (7092): 513–7. Bibcode:2006 yil Nat.441..513U. doi:10.1038 / nature04782. PMID 16724068. S2CID 4423494.
- ^ Sun S, Li D, Xo AS, Pu JK, Chjan XQ, Li NP, Day PJ, Lui WM, Fung CF, Leung GK (may 2013). "Prolil 4-gidroksilaza, beta polipeptid (P4HB) ning inhibisyoni, endoplazmatik retikulumning stress reaktsiyasi (ERSR) yo'llari orqali malign gliomada temozolomid qarshiligini susaytiradi". Neyro-onkologiya. 15 (5): 562–77. doi:10.1093 / neuonc / not005. PMC 3635523. PMID 23444257.
- ^ Rauch F, Fahiminiya S, Majewski J, Sabzi-Zhang J, Boudko S, Glorieux F, Mort JS, Bächinger HP, Moffatt P (mart 2015). "Koul-Karpenter sindromi P4HBdagi heterozigotli misens mutatsiyasidan kelib chiqadi". Amerika inson genetikasi jurnali. 96 (3): 425–31. doi:10.1016 / j.ajhg.2014.12.027. PMC 4375435. PMID 25683117.
- ^ Ko HS, Uehara T, Nomura Y (sentyabr 2002). "Endoplazmatik retikulumda oqsil-disulfid izomeraza bilan bog'liq bo'lgan ubiquilinning roli stressli apoptotik hujayralar o'limida". Biologik kimyo jurnali. 277 (38): 35386–92. doi:10.1074 / jbc.M203412200. PMID 12095988.
- ^ a b Anelli T, Alessio M, Mezghrani A, Simmen T, Talamo F, Bachi A, Sitia R (2002 yil fevral). "ERp44, tioredoksinlar oilasining yangi endoplazmik retikulum katlama yordamchisi". EMBO jurnali. 21 (4): 835–44. doi:10.1093 / emboj / 21.4.835. PMC 125352. PMID 11847130.
- ^ a b Mezghrani A, Fassio A, Benham A, Simmen T, Braakman I, Sitia R (Noyabr 2001). "Sutemizuvchi hujayralardagi oksidlovchi oqsil katlamasi va PDI oksidlanish-qaytarilish holati manipulyatsiyasi". EMBO jurnali. 20 (22): 6288–96. doi:10.1093 / emboj / 20.22.6288. PMC 125306. PMID 11707400.
Qo'shimcha o'qish
- Galligan JJ, Petersen DR (iyul 2012). "Inson oqsillari disulfid izomeraza genlari oilasi". Inson genomikasi. 6: 6. doi:10.1186/1479-7364-6-6. PMC 3500226. PMID 23245351.
- Wilkinson B, Gilbert HF (iyun 2004). "Protein disulfid izomerazasi". Biochimica et Biofhysica Acta. 1699 (1–2): 35–44. doi:10.1016 / j.bbapap.2004.02.017. PMID 15158710.
- Pihlajaniemi T, Myllylä R, Kivirikko KI (1992). "Prolil 4-gidroksilaza va uning kollagen sintezidagi ahamiyati". Gepatologiya jurnali. 13 Qo'shimcha 3: S2-7. doi:10.1016 / 0168-8278 (91) 90002-S. PMID 1667665.
- Wilkinson B, Gilbert HF (iyun 2004). "Protein disulfid izomerazasi". Biochimica et Biofhysica Acta. 1699 (1–2): 35–44. doi:10.1016 / j.bbapap.2004.02.017. PMID 15158710.
- Hochstrasser DF, Frutiger S, Paket N, Bayroch A, Ravier F, Pasquali C, Sanches JC, Tissot JD, Bjellqvist B, Vargas R (dekabr 1992). "Inson jigari oqsillari xaritasi: mikrosekvensiya va gelni taqqoslash yo'li bilan tashkil etilgan ma'lumot bazasi" Elektroforez. 13 (12): 992–1001. doi:10.1002 / elps.11501301201. PMID 1286669. S2CID 23518983.
- Chessler SD, Byers PH (aprel, 1992). "Gly-X-Y takroriy naqshini saqlaydigan pro alfa 2 (I) zanjirida o'chirish bilan I tipdagi prokololenning oqsil disulfid izomeraza / proil gidroksilaza bilan defektli katlama va barqaror birikma". Biologik kimyo jurnali. 267 (11): 7751–7. PMID 1339453.
- Vuori K, Myllylä R, Pihlajaniemi T, Kivirikko KI (aprel 1992). "Escherichia coli tarkibidagi inson oqsillari disulfid izomerazasining ekspressioni va yo'naltirilgan mutagenezi. Ushbu ko'p funktsional polipeptid izomeraza faolligi uchun ikkita mustaqil ta'sir ko'rsatadigan katalitik maydonga ega". Biologik kimyo jurnali. 267 (11): 7211–4. PMID 1559965.
- Tasanen K, Oikarinen J, Kivirikko KI, Pihlajaniemi T (iyun 1992). "Ko'p funktsiyali oqsil disulfid izomeraza polipeptidi genining targ'ibotchisi. Oltita CCAAT qutisi va boshqa promotor elementlarning funktsional ahamiyati". Biologik kimyo jurnali. 267 (16): 11513–9. PMID 1597478.
- Bau G, Rasmussen HH, van den Bulke M, van Damm J, Puayp M, Gesser B, Celis JE, Vandekerxov J (iyul 1990). "Ikki o'lchovli gel elektroforez, oqsillarni elektroblotlash va mikrosekventsiya: oqsillar va genlar o'rtasidagi to'g'ridan-to'g'ri bog'liqlik". Elektroforez. 11 (7): 528–36. doi:10.1002 / elps.1150110703. PMID 1699755. S2CID 24768114.
- Ward LD, Hong J, Whitehead RH, Simpson RJ (oktyabr 1990). "Ikki o'lchovli poliakrilamidli gel elektroforezi bilan ajratilgan odam yo'g'on ichak karsinomasi oqsillari uchun aminokislotalar ketma-ketliklari ma'lumotlar bazasini yaratish". Elektroforez. 11 (10): 883–91. doi:10.1002 / elps.1150111019. PMID 2079031. S2CID 21541503.
- Tasanen K, Parkkonen T, Chow LT, Kivirikko KI, Pihlajaniemi T (noyabr 1988). "Prolip 4-gidroksilazaning beta birligi va oqsil disulfid izomerazasi vazifasini bajaradigan polipeptid uchun inson genining xarakteristikasi". Biologik kimyo jurnali. 263 (31): 16218–24. PMID 2846539.
- Koivu J, Myllylä R, Helaakoski T, Pihlajaniemi T, Tasanen K, Kivirikko KI (may 1987). "Yagona polipeptid prolin 4-gidroksilaza beta birligi sifatida ham, oqsil disulfid-izomeraza sifatida ham ishlaydi". Biologik kimyo jurnali. 262 (14): 6447–9. PMID 3032969.
- Pihlajaniemi T, Helaakoski T, Tasanen K, Myllylä R, Huhtala ML, Koivu J, Kivirikko KI (mart 1987). "Inson prolin 4-gidroksilaza beta-bo'linmasini molekulyar klonlash. Ushbu subbirlik va disulfid izomeraza oqsillari bir xil gen mahsulotidir". EMBO jurnali. 6 (3): 643–9. doi:10.1002 / j.1460-2075.1987.tb04803.x. PMC 553446. PMID 3034602.
- Morris JI, Varandani PT (fevral, 1988). "Odam glutation-insulin transhidrogenaza (protein-disulfid izomeraza / oksidoreduktaza) uchun cDNA ning xarakteristikasi". Biochimica et Biofhysica Acta (BBA) - Genlarning tuzilishi va ifodasi. 949 (2): 169–80. doi:10.1016/0167-4781(88)90080-2. PMID 3342239.
- Gosden JR, Middlton PG, Rout D, De Angelis C (1987). "ERBA2 inson onkogenining xromosomal lokalizatsiyasi". Sitogenetika va hujayra genetikasi. 43 (3–4): 150–3. doi:10.1159/000132313. PMID 3467900.
- Cheng SY, Gong QH, Parkison C, Robinzon EA, Appella E, Merlino GT, Pastan I (avgust 1987). "Endoplazmik retikulumda mavjud bo'lgan inson hujayrasi qalqonsimon bez gormonining bog'lovchi oqsilining nukleotidlar ketma-ketligi". Biologik kimyo jurnali. 262 (23): 11221–7. PMID 3611107.
- Helaakoski T, Annunen P, Vuori K, MacNeil IA, Pihlajaniemi T, Kivirikko KI (may 1995). "Klonlash, bakulovirus ekspressioniyasi va ikkinchi sichqon prolin 4-gidroksilaza alfa-subunit izoformasining xarakteristikasi: disulfid-izomeraza / beta subbirligi bilan alfa 2 beta 2 tetramer hosil bo'lishi". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 92 (10): 4427–31. doi:10.1073 / pnas.92.10.4427. PMC 41957. PMID 7753822.
- Kemmink J, Darby NJ, Dijkstra K, Scheek RM, Creighton TE (dekabr 1995). "Disulfid oqsili izomerazasining N-terminalli tioredoksinga o'xshash domenining yadro magnit-rezonans xarakteristikasi". Proteinli fan. 4 (12): 2587–93. doi:10.1002 / pro.5560041216. PMC 2143042. PMID 8580850.
- Kemmink J, Darby NJ, Dijkstra K, Nilges M, Creighton TE (iyun 1996). "Ko'p o'lchovli heteronukleer 13C / 15N NMR spektroskopiyasi yordamida oqsil disulfid izomerazasining N-terminalli tioredoksinga o'xshash domenini tuzilishini aniqlash". Biokimyo. 35 (24): 7684–91. doi:10.1021 / bi960335m. PMID 8672469.
- Dji X, Reid GE, Moritz RL, Eddes JS, Burgess AW, Simpson RJ (1997). "Inson yo'g'on ichak karsinomasi oqsillarining ikki o'lchovli gel ma'lumotlar bazasi". Elektroforez. 18 (3–4): 605–13. doi:10.1002 / elps.1150180344. PMID 9150948. S2CID 25454450.