Natriy tetrasulfid - Sodium tetrasulfide - Wikipedia
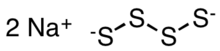 | |
| Ismlar | |
|---|---|
| IUPAC nomi Natriy tetrasulfid | |
| Boshqa ismlar disodyumtetrasulfid, natriy sulfid | |
| Identifikatorlar | |
| ECHA ma'lumot kartasi | 100.031.628 |
| EC raqami |
|
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| Xususiyatlari | |
| Na2S4 | |
| Molyar massa | 174,24 g / mol |
| Tashqi ko'rinishi | To'q qizil, ozgina yopishqoq suyuqlik yoki sariq rangli kristalli kukun |
| Zichlik | 1.268 g / sm3 15,5 ° S da |
| Erish nuqtasi | 275 ° C (527 ° F; 548 K) |
| Suvda eriydi | |
| Xavf | |
| Asosiy xavf | Xona haroratida barqaror, lekin qizdirilganda portlovchi bo'lishi mumkin. Kislotalar yoki oksidlovchi moddalar bilan reaktsiyalar natijasida nafas olganda xavfli bo'lgan gazli yon mahsulotlar hosil bo'ladi. |
| Xavfsizlik ma'lumotlari varaqasi | [1] [1] |
| NFPA 704 (olov olmos) | |
| Qo'llanilmaydigan, qo'llab bo'lmaydigan | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Natriy tetrasulfid bu noorganik birikma formulasi bilan Na2S4. Bu suvda gidroliz bilan erigan sariq-to'q sariq rangli qattiq moddadir.[2] Ular ba'zi bir maxsus polimerlarning kashfiyotchilari va prototiplarining oraliq moddalari natriy-oltingugurt batareyasi.
Sintez va tuzilish
Alkogolli eritmadagi elementar oltingugurt va natriy gidrosulfid o'rtasidagi reaktsiya natijasida hosil bo'ladi:[3]
- 2NaSH + 4 S → Na2S4 + H2S
Polisulfid anionlari oltingugurt atomlarining zig-zag zanjirlarini qabul qiladi. S-S masofalari taxminan 2,05 are va S-S-S-S dihedral burchaklari 90 ° atrofida.[4]
Reaksiyalar va ilovalar
Kislota bilan davolashda u aylanadi vodorod sulfidi va elementar oltingugurt. Alkilatuvchi moddalar bilan davolash organik polisulfidlarni beradi. Bitta tijorat dasturida u ishlab chiqarish uchun ishlatiladi o'zaro bog'liqlik agent bis (trietoksisililpropil) tetrasulfid:[5]
- Na2S4 + 2 ClC3H6Si (OEt)3 → S.4[C3H6Si (OEt)3]2 + 2 NaCl
Ba'zan boshqalari bilan aralashmasi sifatida polisulfidlar, natriy tetrasulfid tiokol deb nomlangan polimer ishlab chiqarish uchun ishlatiladi. Reaksiya bilan alkilatsiyani o'z ichiga oladi etilen xlorid:
- Na2S4 + C2H4Cl2 → 1 / n (C2H4S)x]n + 2 NaCl
Taxminan formulaga ega bo'lgan ushbu materiallar (C2H4S)x]n (x ~ 4), erituvchilar va kislotalarning parchalanishiga yuqori darajada chidamli.[6]
Adabiyotlar
- ^ "Xavfsizlik ma'lumotlari, natriy tetrasulfid" (PDF). Pfaltz va Bauer.
- ^ Preparat noorganik kimyo bo'yicha qo'llanma, 2-nashr. G. Brauer tomonidan tahrirlangan, Academic Press, 1963, NY. Vol. 1. p. 365.
- ^ D. R. Brush (2000). "Natriy sulfidlari". Kirk-Omer kimyo texnologiyasi entsiklopediyasi. Kirk-Omer kimyo texnologiyasi entsiklopediyasi. doi:10.1002 / 0471238961.1915040902211908.a01. ISBN 0471238961.
- ^ R. Tegman "Natriy tetrasulfidning kristalli tuzilishi, Na2S4"Acta Crystallogr. (1973). B29, 1463-1469 doi:10.1107 / S0567740873004735
- ^ Turn, Fridrix; Meyer-Simon, Evgen; Mishel, Rudolf "Verfahren zur Herstellung von Organosiliziumverbindungen (Bisni doimiy ishlab chiqarish [3- (trietoksizil) propil] tetrasulfid)" Ger. Yomon. (1973), DE 2212239 A1 19731004.
- ^ Sulfidlar, polisulfidlar va sulfanlar "Ullmanning Sanoat kimyosi ensiklopediyasida Lyudvig Lange va Volfgang Tribel, 2000, Vili-VCH, Vaynxaym. doi:10.1002 / 14356007.a25_443

