Treonin ammiak-liaza - Threonine ammonia-lyase
| L-treonin ammiak-liaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Treonin deaminaza tetramerining 3D multfilmi tasvirlangan | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 4.3.1.19 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Treonin ammiak-liaza, shuningdek, odatda deb nomlanadi treonin deaminaz yoki treonin dehidrataza, bu ferment javobgar katalizator konvertatsiya qilish L-treonin ichiga alfa-ketobutirat va ammiak. Alfa-ketobutiratni aylantirish mumkin L-izolösin, shuning uchun treonin ammiak-liaza tarkibidagi asosiy ferment sifatida ishlaydi BCAA sintez.[1] U ishlaydi piridoksal-5'-fosfat kofaktor, ishtirok etgan ko'plab fermentlarga o'xshash aminokislota metabolizm. Bu topilgan bakteriyalar, xamirturush va o'simliklar, ammo hozirgi kungacha o'tkazilgan tadqiqotlarning aksariyati bakteriyalardagi ferment shakllariga qaratilgan. Ushbu ferment birinchilardan biri bo'lgan salbiy teskari aloqa a ning oxirgi mahsuloti bilan inhibisyon metabolik yo'l to'g'ridan-to'g'ri kuzatilgan va o'rganilgan.[2] Ferment aminokislotada ishlatiladigan tartibga solish strategiyasining ajoyib namunasi bo'lib xizmat qiladi gomeostaz.
Tuzilishi
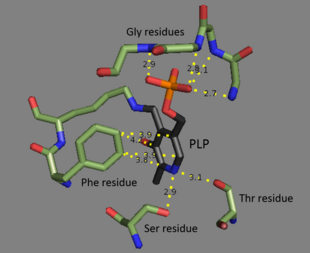
Treonin ammiak-liaza - bu a tetramer bir xil subbirliklar, va a sifatida joylashtirilgan dimer dimerlar. Har bir kichik bo'limda ikkitadan domenlar: katalitik faol saytni o'z ichiga olgan domen va allosterik tartibga soluvchi saytlar. Ikkalasi aniq mintaqalar ekanligi ko'rsatilgan,[3] ammo bir subbirlikning regulyativ sayti boshqa subbirlikning katalitik uchastkasi bilan o'zaro ta'sir qiladi.[4] Ikkala sohada ham takrorlanadigan strukturaviy motiv mavjud beta-varaqlar bilan o'ralgan alfa spirallari.[5] Treonin bilan bog'lanish joyi to'liq tushunilmagan bo'lsa-da, tizimli tadqiqotlar piridoksal fosfat kofaktorining qanday bog'langanligini aniqlaydi.[4] PLP kofaktori a bilan bog'langan lizin a. yordamida qoldiq Shiff bazasi, va fosfat PLP guruhi tomonidan ushlab turiladi omin ning takrorlanadigan ketma-ketligidan kelib chiqqan guruhlar glitsin qoldiqlar. The xushbo'y uzuk bog'langan fenilalanin va halqadagi azot vodorod bog'langan ga gidroksil guruh tarkibidagi qoldiqlar.[6]
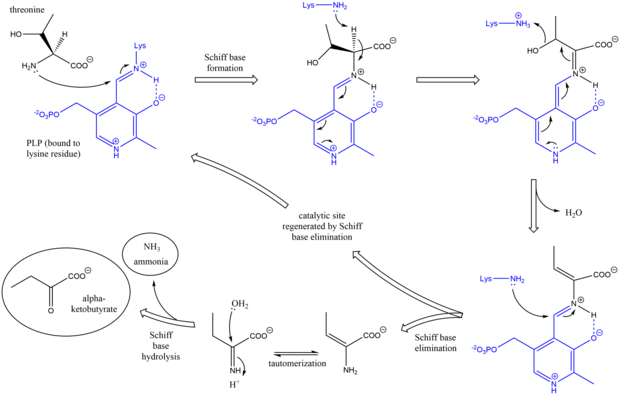
Mexanizm
Treonin ammiak-liaza mexanizmi Schiff bazasini ishlatishda boshqa dezinfektsiyalovchi PLP fermentlariga o'xshaydi. oraliq mahsulotlar.[7] Dastlab, treoninning omin guruhi lizinni almashtirib, lizin / PLP Shiff bazasiga hujum qiladi. Keyin deprotonatsiya aminokislota alfa uglerod va keyingi suvsizlanish (shuning uchun treonin umumiy nomi dehidrataza), yangi Shiff bazasi shakllantirildi. Ushbu Schiff bazasi lizin hujumi bilan almashtirilib, katalitik jihatdan faol PLPni isloh qiladi va boshlang'ichni chiqaradi alken - tarkibidagi mahsulot. Ushbu mahsulot tautomerizatsiya qiladi va undan keyin gidroliz Shiff bazasidan yakuniy mahsulotlar ishlab chiqariladi.[8][9] Yakuniy alfa-ketobutirat mahsuloti hosil bo'lgandan so'ng, izoleusin alfa-asetohidroksibutirat oraliq moddalar orqali alfa-beta-dihidroksi-beta-metilvalerat, so'ngra alfa-keto-beta-metilvalerat orqali sintezlanadi.[10]
Tartibga solish
Treonin ammiak-liaza amal qilmasligi isbotlangan Michaelis-Menten kinetikasi aksincha, bu kompleks allosterik nazoratga bo'ysunadi.[11] Ferment taqiqlangan u ishtirok etadigan va faollashtiradigan yo'lning hosilasi bo'lgan izolösin bilan valin, parallel yo'lning hosilasi.[1] Shunday qilib, izolösin kontsentratsiyasining oshishi uning ishlab chiqarilishini to'xtatadi va valin kontsentratsiyasining oshishi boshlang'ich moddasini yo'naltiradi (Gidroksietil-)IES ) valin ishlab chiqarishdan uzoqda. Fermentning izoleusin uchun ikkita bog'lanish joyi mavjud; bittasi yuqori qarindoshlik izolösin uchun, ikkinchisida esa yaqinligi past.[12] Izoleusinni yuqori afinitik uchastkaga bog'lab turishi past afinitellik uchastkasining bog'lanish yaqinligini oshiradi va fermentning deaktivatsiyasi izoletsin past afinit maydoniga bog'langanda sodir bo'ladi. Valin fermentlarning faolligini yuqori afinitellik maydoniga raqobatbardosh ravishda bog'lab, izoleusinning inhibitiv ta'sirini oldini oladi.[12] Ushbu ikkita qayta aloqa usulining kombinatsiyasi BCAA konsentratsiyasini muvozanatlashtiradi.

Isoformlar va boshqa funktsiyalar
Bir nechta shakllari treonin ammiak-liazning turli xillarida kuzatilgan turlari organizm. Yilda Escherichia coli, ferment keng o'rganilgan tizim, fermentning ikki xil shakli topilgan. Bittasi biosintez va bu erda keltirilgan ferment xususiyatlariga o'xshaydi, ikkinchisi esa degradativ va uglerod parchalarini hosil qilish funktsiyalari energiya ishlab chiqarish.[2] Izoformalarning juftligi boshqa bakteriyalarda ham kuzatilgan. Ko'pgina bakteriyalarda fermentning biodegradativ izoformasi ifoda etilgan anaerob shartlari va tomonidan targ'ib qilinadi lager va treonin, biosintezli izoform esa ifodalanadi aerob shartlar.[13] Bu bakteriya energiya zaxiralarini muvozanatlashiga va energiya ko'p bo'lmagan paytda energiya iste'mol qiladigan sintetik yo'llarni inhibe qilishga imkon beradi.
O'simliklarda treonin ammiak-liaza himoya mexanizmlarida muhim ahamiyatga ega o'txo'rlar va javoban tartibga solinadi abiotik stress.[14] O'txo'r hayvonlarni to'xtatadigan noyob xususiyatlarga ega fermentning moslashtirilgan izoformasi o'simlik barglarida ifodalanadi. Ushbu izoformning katalitik sohasi juda chidamli proteoliz, tartibga solish sohasi tezda tanazzulga uchragan bo'lsa, shuning uchun boshqa organizm tomonidan qabul qilinganida, fermentning treoninni dezaminatsiya qilish qobiliyatlari tekshirilmaydi. Bu trioninni o'txo'rlar so'rib olguncha tanazzulga uchraydi va an o'simlik o'ti iste'mol qiladi muhim aminokislota.[15] O'simliklardagi treonin ammiak-liazani o'rganish ham rivojlanishning yangi strategiyalarini taklif qildi GMO muhim aminokislota tarkibini oshirish orqali ozuqaviy qiymati oshishi bilan.[14]
Fermentning boshqa ekzotik shakllari juda kichik bo'lgan, ammo katalitik va tartibga solish funktsiyalarini saqlab qolganligi aniqlandi.[4]
Evolyutsiya
PLPga bog'liq fermentlar uchun beshta asosiy katlama turi mavjud. Treonin ammiak-liaza - bu katlama turi II oilasining a'zosi, shuningdek triptofan sintaz oila.[7] Treonin ammiak-liaza mavjud bo'lmasa ham substratni tunnellash triptofan sintazi singari, u juda ko'p konservalangan homologiya. Treonin ammiak-liaza eng yaqin bog'liqdir serin dehidrataza va ikkalasi ham bir xil umumiy katalitik mexanizmga ega.[9] Darhaqiqat, treonin ammiak-liazasi o'ziga xos xususiyatlarini namoyish etdi serin va serinni o'zgartirishi mumkin piruvat.[2] Treonin ammiak-liazaning tartibga solish sohasi, ning regulyatsion sohasiga juda o'xshash fosfogliserat dehidrogenaza.[4] Ushbu munosabatlarning barchasi treonin ammiak-liaza yaqinligini ko'rsatadi evolyutsion bu fermentlar bilan bog'lanadi. Konservalanganlik darajasi tufayli tuzilishi va ketma-ketlik aminokislotalarni taniydigan fermentlarda, ehtimol bu fermentlarning evolyutsion xilma-xilligi individual tartibga soluvchi va katalitik domenlarning turli yo'llar bilan uyg'unligi natijasida yuzaga kelgan.[1]
Odamlar uchun dolzarbligi
Treonin ammiak-liaza odamlarda mavjud emas. Shunday qilib, bu nima uchun odamlar 20 ta sintez qila olmasligining bir misolidir proteinogen aminokislotalar; bu o'ziga xos holatda, odamlar treoninni izolösinga aylantira olmaydi va dietada izoleusinni iste'mol qilishi kerak.[1] Ilgari ferment ham iloji boricha o'rganilgan o'smani bostiruvchi vosita ilgari tasvirlangan sabablarga ko'ra, u o'simta hujayralarini muhim aminokislotadan mahrum qiladi va ularni o'ldiradi,[16] ammo bu muolajadan foydalanilmagan.
Adabiyotlar
- ^ a b v d e Berg JM, Timoczko JL, Stryer L (2012). Biokimyo (7-nashr). Nyu-York: W.H. Freeman and Company. ISBN 978-1-4292-7635-1.
- ^ a b v Umbarger HE, Brown B (yanvar 1957). "Escherichia coli-da treonin deaminatsiyasi. II. Ikki L-treonin deaminazasi uchun dalillar". Bakteriologiya jurnali. 73 (1): 105–12. doi:10.1128 / jb.73.1.105-112.1957. PMC 289754. PMID 13405870.
- ^ Changeux J (1963). "E. coli K12 dan biosintetik L-treonin Deaminaza bo'yicha allosterik o'zaro ta'sirlar". Kantitativ biologiya bo'yicha sovuq bahor porti simpoziumlari. 28: 497–504. doi:10.1101 / SQB.1963.028.01.066.
- ^ a b v d Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eyzenshteyn E (aprel, 1998). "Piridoksal fosfatga bog'liq allosterik treonin deaminaza tuzilishi va boshqarilishi". Tuzilishi. 6 (4): 465–75. doi:10.1016 / s0969-2126 (98) 00048-3. PMID 9562556.
- ^ Schneider G, Käck H, Lindqvist Y (yanvar 2000). "B6 vitaminiga bog'liq fermentlarning ko'p qirrasi". Tuzilishi. 8 (1): R1-6. doi:10.1016 / S0969-2126 (00) 00085-X. PMID 10673430.
- ^ a b Goto M (2005). "T.th. HB8 treonin deaminazasining kristalli tuzilishi". doi:10.2210 / pdb1ve5 / pdb. Iqtibos jurnali talab qiladi
| jurnal =(Yordam bering) - ^ a b Eliot AC, Kirsch JF (2004). "Piridoksal fosfat fermentlari: mexanistik, strukturaviy va evolyutsion mulohazalar". Biokimyo fanining yillik sharhi. 73 (1): 383–415. doi:10.1146 / annurev.biochem.73.011303.074021. PMID 15189147.
- ^ a b Umbarger HE (2009). "Treonin deaminazlari". Meister A-da (tahrir). Enzimologiya va molekulyar biologiyaning tegishli sohalaridagi yutuqlar. Enzimologiya yutuqlari - va molekulyar biologiyaning tegishli sohalari. 37. John Wiley & Sons. 349-95 betlar. doi:10.1002 / 9780470122822.ch6. ISBN 978-0-471-59172-6. PMID 4570068.
- ^ a b v Jin J, Hanefeld U (mart 2011). "C = C birikmalariga suv tanlab qo'shilishi; fermentlar eng yaxshi kimyogar". Kimyoviy aloqa. 47 (9): 2502–10. doi:10.1039 / c0cc04153j. PMID 21243161.
- ^ Squires CH, Levinthal M, De Felice M (1981 yil noyabr). "Escherichia coli K12 da alfa-asetolaktat biosintezini boshqarishda treonin deaminazining roli". Umumiy mikrobiologiya jurnali. 127 (1): 19–25. doi:10.1099/00221287-127-1-19. PMID 7040602.
- ^ Changeux JP (1961). "L-izolösin bilan biosintez qiluvchi L-treonin deaminazani qayta tiklash mexanizmlari". Kantitativ biologiya bo'yicha sovuq bahor porti simpoziumlari. 26: 313–8. doi:10.1101 / SQB.1961.026.01.037. PMID 13878122.
- ^ a b Vessel PM, Graciet E, Duce R, Dumas R (2000 yil dekabr). "Uchastka yo'naltirilgan mutagenez, kinetik va bog'lash tajribalari bo'yicha treonin deaminazdagi ikkita aniq effektor bilan bog'lanish joylari uchun dalillar" (PDF). Biokimyo. 39 (49): 15136–43. doi:10.1021 / bi001625c. PMID 11106492.
- ^ Luginbuhl GH, Xofler JG, Decedue CJ, Berns RO (oktyabr 1974). "Salmonella typhimurium biodegradativ L-treonin deaminazasi". Bakteriologiya jurnali. 120 (1): 559–61. doi:10.1128 / jb.120.1.559-561.1974. PMC 245803. PMID 4370904.
- ^ a b Joshi V, Joung JG, Fei Z, Jander G (2010 yil oktyabr). "O'simliklardagi treonin, metionin va izoleusin almashinuvining o'zaro bog'liqligi: abiotik stress ostida to'planish va transkripsiyaviy tartibga solish". Aminokislotalar. 39 (4): 933–47. doi:10.1007 / s00726-010-0505-7. PMID 20186554.
- ^ Gonzales-Vigil E, Bianchetti CM, Phillips GN, Howe GA (aprel 2011). "Hasharotlarga qarshi o'simliklardan himoya qilishda treonin deaminazning adaptiv evolyutsiyasi". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 108 (14): 5897–902. doi:10.1073 / pnas.1016157108. PMC 3078374. PMID 21436043.
- ^ Greenfield RS, Wellner D (avgust 1977). "Treonin deaminazning to'qima madaniyatidagi sutemizuvchilar hujayralarining o'sishi va hayotiyligiga ta'siri va uning leykemiya hujayralariga nisbatan selektiv sitotoksikligi". Saraton kasalligini o'rganish. 37 (8 Pt 1): 2523-9. PMID 559542.