Bariy ferrat - Barium ferrate
 | |||
| |||
| Ismlar | |||
|---|---|---|---|
| IUPAC nomi Bariy ferrat (VI) | |||
| Boshqa ismlar Bariy ferrat (2-) | |||
| Identifikatorlar | |||
3D model (JSmol ) | |||
| |||
| |||
| Xususiyatlari | |||
| BaFeO4 | |||
| Molyar massa | 257,1646 g / mol | ||
| Tashqi ko'rinishi | To'q qizil, shaffof bo'lmagan kristallar | ||
| erimaydigan | |||
| Tuzilishi | |||
| ortorombik | |||
| Pnma, № 62[1] | |||
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |||
| Infobox ma'lumotnomalari | |||
Bariy ferrat bo'ladi kimyoviy birikma BaFeO formulasidan4. Bu o'z ichiga olgan noyob birikma temir +6 da oksidlanish darajasi.[2] Ferrat (VI) ionida uni juftlashtirilmagan ikkita elektron bor paramagnetik.[3] Bu izostrukturali BaSO4 va tarkibida tetraedral mavjud [FeO4]2− anion.[4]
Tuzilishi
The ferrat (VI) anion ikkitasi tufayli paramagnetikdir juft bo'lmagan elektronlar va u bor tetraedral molekulyar geometriya.[3]
Rentgen difraksiyasi ortorhombik birlik hujayra tuzilishini aniqlash uchun ishlatilgan[1] (panjara vektorlari a ≠ b ≠ c, interaksial burchaklar a = β = γ = 90 °)[5] nanokristalli BaFeO4. U Pnmada kristallangan kosmik guruh (nuqta guruhi: D.2 soat) panjara parametrlari bilan a = 0,8880 nm, b = 0,5512 nm va v = 0,7214 nm.[1] X-ray difraksiyasi ma'lumotlarining to'g'riligi dan panjaraning chekka intervallari bilan tasdiqlangan Yuqori aniqlikdagi uzatuvchi elektron mikroskopi (HRTEM) va dan hisoblangan hujayra parametrlari Tanlangan maydon difraksiyasi (SAED).[1]

Xarakteristikasi
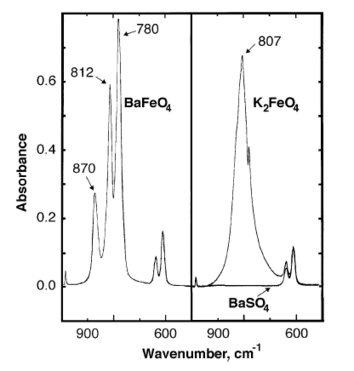
Infraqizil bariy ferratining yutilish cho'qqilari 870, 812, 780 sm da kuzatiladi−1.[7]
BaFeO4 magnit momenti (3.20 ± 0.09) x Am ga teng2 (3.45 ± 0.1BM) bilan Vayss doimiy -89 K.[9]
Tayyorgarlik va kimyo
Ferrat (VI) ishlab chiqarishning ikkita usuli mavjud: quruq va nam sintetik usullar.
Quruq sintetik usul odatda issiqlik texnikasi yordamida amalga oshiriladi.[7] Nam usul kimyoviy va elektrokimyoviy usullardan foydalanadi. Erituvchi bariy tuzini gidroksidi metall ferrat eritmasiga qo'shganda bariy ferratning maroon cho'kmasi hosil bo'ladi, kristall xuddi shunday tuzilishga ega. bariy xromat va taxminan bir xil eruvchanlikka ega.[10] Bariy ferrat, BaFeO4, xona haroratida (yoki 0 ° C) NaClO va temir nitrat aralashmasiga bariy oksidi qo'shib tayyorlash mumkin.[11]Birlamchi tajribalar karbonat angidrid bo'lmagan holda past haroratda reaktsiyani amalga oshirish va cho'kmani tez filtrlash va quritish orqali sintez qilingan bariy ferratining tozaligi yaxshilanganligini ko'rsatadi.[10]
Foydalanadi
Bariy ferrat an oksidlovchi vosita va organik sintezlarda oksidlovchi reaktiv sifatida ishlatiladi. Uning boshqa qo'llanmalariga rangni yo'qotish, siyanidni yo'q qilish, bakteriyalarni yo'q qilish va ifloslangan va chiqindi suvlarni tozalash kiradi.[7]
Ferratning tuzlari (VI) - bu "super temir" batareyalaridagi katodli energetik materiallar. Ferrat (VI) birikmalarini o'z ichiga olgan katodlar yuqori darajada oksidlangan temir asoslari, elektronlarning ko'p o'tkazilishi va ichki energiya yuqori bo'lganligi sababli "super temir" katodlar deb nomlanadi. Barcha ferrat (VI) tuzlari orasida bariy ferrati odatiy bo'lmagan zaryadlarni uzatishni ta'minlaydi, bu esa yuqori quvvat sohasi uchun muhimdir. gidroksidi batareyalar.[8]
Reaksiyalar
Bariy ferrat ferrat (VI) birikmalarining eng barqaroridir. U toza holatda tayyorlanishi mumkin va eng aniq tarkibga ega. Bariy ferrat barcha eruvchan kislotalar, shu jumladan karbonat kislota tomonidan osonlikcha parchalanishi mumkin. Agar karbonat angidrid gidratlangan bariy ferrat to'xtatilgan suvdan o'tkazilsa, bariy ferrat butunlay parchalanib, hosil bo'ladi bariy karbonat, temir gidroksidi va kislorodli gaz. Ishqoriy sulfatlar quritilmagan bariy ferratini parchalab, bariy sulfat, temir gidroksidi va kislorod gazini hosil qiladi.
Shuningdek qarang
Adabiyotlar
- ^ a b v d Ni, Xiao-Min; Dji, Ming-Rong; Yang, Chji-Ping; Chjen, Xua-Guy (2004 yil 15 yanvar). "Nanokristalli BaFeO4 ning tayyorlanishi va tuzilishini tavsiflash". Kristal o'sish jurnali. 261 (1): 82–86. doi:10.1016 / j.jcrysgro.2003.09.024.
- ^ Briggs, J. G. R. (2005). Longman A-darajali kimyo kursi (4-nashr). Pearson Education Janubiy Osiyo. p. 536. ISBN 978-981-4105-08-8.
- ^ a b Wiberg, Egon; Wiberg, Nils; Xolman, Arnold (2001). Anorganik kimyo. Akademik matbuot. 1457-1458 betlar. ISBN 978-0-12-352651-9.
- ^ Uells, A.F. (1986). Strukturaviy anorganik kimyo (5-nashr). Oksford [Oksfordshir]: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ "IUCr". www.iucr.org. Olingan 2016-04-29.
- ^ Ropp, Richard C. (2012-12-31). Ishqoriy yer birikmalari entsiklopediyasi. Nyu-York. ISBN 9780444595539.
- ^ a b v Genri-Chayz, Adonika; Tewari, Brij Bhushan (2013 yil 20 sentyabr). "Atrof-muhitni tiklash uchun yashil kimyoviy moddalarni fermentatsiyalash (VI) uchun foydalaning" (PDF). Revista Boliviana de Quimica. 30 (1): 13–23. ISSN 0250-5460. Olingan 29 aprel 2016.
- ^ a b Lixt, Styuart; Naschits, Vera; Vang, Baohui (2002). "Bariy ferrat super temir Fe (VI) birikmasining tezkor kimyoviy sintezi, BaFeO4". Quvvat manbalari jurnali. 109: 67–70. doi:10.1016 / s0378-7753 (02) 00041-1.
- ^ Audette, R. J .; Bedana, J. V. (1972). "Kaliy, rubidiy, seziy va bariy ferratlari (VI). Preparatlar, infraqizil spektrlar va magnit ta'sirchanligi". Anorganik kimyo. 11 (8): 1904–1908. doi:10.1021 / ic50114a034.
- ^ a b Gump, J. R .; Vagner, V. F.; Schreyer, J. M. (1954-12-01). "Bariy Ferratni tayyorlash va tahlil qilish (VI)". Analitik kimyo. 26 (12): 1957. doi:10.1021 / ac60096a027. ISSN 0003-2700.
- ^ Xerber, Rolfe H.; Jonson, Devid (1979). "M2FeO4 (M = kaliy (1+), rubidiy (1+), seziy (1+)) va M'FeO4 (M '= stronsiyum (2+), bor (2+)) da panjara dinamikasi va giperfinning o'zaro ta'siri" . Anorganik kimyo. 18 (10): 2786–2790. doi:10.1021 / ic50200a030.


