Sitoxrom P450 aromatik O-demetilaza - Cytochrome P450 aromatic O-demethylase
| Aromatik O-demetilaza, sitokrom P450 subbirligi | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identifikatorlar | |||||||
| Organizm | |||||||
| Belgilar | gcoA | ||||||
| PDB | 5NCB | ||||||
| UniProt | P0DPQ7 | ||||||
| Boshqa ma'lumotlar | |||||||
| EC raqami | 1.14.14.- | ||||||
| |||||||
| Aromatik O-demetilaza, reduktaza subbirligi | |||||||
|---|---|---|---|---|---|---|---|
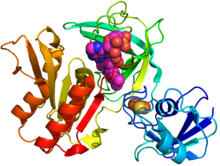 GcoB (multfilm diagrammasi) ning kristalli tuzilishi FAD (qizil sharlar) va an temir-oltingugurt klasteri (to'q sariq / sariq) asosida PDB: 5OGX.[1] | |||||||
| Identifikatorlar | |||||||
| Organizm | |||||||
| Belgilar | gcoB | ||||||
| PDB | 5OGX | ||||||
| UniProt | P0DPQ8 | ||||||
| Boshqa ma'lumotlar | |||||||
| EC raqami | 1.6.2.- | ||||||
| |||||||
Sitoxrom P450 aromatik O-demetilaza bakterial hisoblanadi ferment demetilatsiyasini katalizlaydi lignin va turli xil lignollar. Net reaktsiya umumiy metoksi aren bilan tasvirlangan quyidagi stokiometriyadan kelib chiqadi:[1]
- ArOCH3 + O2 + 2 e− + 2 H+ → ArOH + CH2O + H2O
Ferment buzuqligi bilan ajralib turadi, u bir qator substratlarning, jumladan ligninning O-demetilatsiyasiga ta'sir qiladi.
Bu heterodimerik ikki gen mahsulotidan olingan oqsil. Tarkibiy oqsillar a sitoxrom P450 ferment (CYP255A turkumidagi gcoA geni bilan kodlangan) va uch domenli reduktaza (gcoB geni bilan kodlangan) uchtasi bilan komplekslangan kofaktorlar (2Fe-2S, FAD va NADH ).[1]

Mexanizm
GcoA va GcoB eritmada dimer kompleksini hosil qiladi. GcoA substratni qayta ishlaydi, GcoB esa aralash oksidaz funktsiyasini qo'llab-quvvatlash uchun elektronlarni beradi. Boshqa P450-larda bo'lgani kabi, substratning monooksigenlanishi O ekvivalentining yarim ekvivalenti kamayishi bilan bir vaqtda davom etadi.2 suvga. An kislorodni qaytarish mexanizmi taxmin qilish mumkin. GcoA aromatik halqani gem joylashgan hidrofob faol joy bo'shlig'iga joylashtiradi.[2][3]

Tuzilishi
GcoA odatdagi P450 tuzilishga ega: ko'milgan faol joy yonida tiolat bilan bog'langan gem. GcoB juda g'alati. Sitoxrom P450'lar odatda sitokrom P450 reduktaza bilan to'ldiriladi[4] yoki ferredoksin va ferredoksin reduktaza; uning elektronlari NAD + yoki NADP +. Ammo GcoB bitta polipeptidga ega. Ushbu polipeptidda NAD (P) + va shuningdek, N-terminalli ferredoksin mavjud FAD majburiy mintaqa.

CcoA va GcoB bir-biri bilan chambarchas bog'liq bo'lib, eritmada heterodimer vazifasini bajaradi. GcoB yuzasida kislotali yamoq mavjud bo'lib, u GcoA tarkibidagi mos keladigan asosiy mintaqa bilan o'zaro ta'sir qilishi kerak. GcoB bilan GcoA bilan o'zaro ta'sir qiluvchi qismi FAD bog'lanish sohasi va ferredoksin domeni o'rtasida kesishgan joyda ekanligi taxmin qilinmoqda. Bunga erishish uchun GcoB P450 tizimlarining yangi sinfini (oila N) ifodalovchi ba'zi bir tarkibiy o'zgarishlarni boshdan kechirishi kerak edi.[5][6][7]
Potentsial dasturlar
Sitoxrom P450 aromatik O-demetilaza ligninning qisman O-demetilatsiyasiga yordam beradi. Olingan 1,2-diollar ichki va qo'shimcha dioksigenazlar orqali oksidlanish buzilishi uchun juda mos keladi. Shunday qilib O-demetillangan ligninlar qisman depolimerizatsiyaga moyil.[8] Kamroq o'zaro bog'liqlik bilan, o'zgartirilgan ligand, avvalgidan ko'ra ko'proq foydali bo'ladi.,[9] yoqilg'idan tortib[10][11]
Adabiyotlar
- ^ a b v d Mallinson SJ, Machovina MM, Silveira RL, Garsiya-Borras M, Gallup N, Jonson CW va boshq. (Iyun 2018). "Lignin biokonversiyasi uchun notekis sitokrom P450 aromatik O-demetilaza". Tabiat aloqalari. 9 (1): 2487. Bibcode:2018NatCo ... 9.2487M. doi:10.1038 / s41467-018-04878-2. PMC 6021390. PMID 29950589.
- ^ Vaillancourt FH, Bolin JT, Eltis LD (2006). "Uzuklarni ajratuvchi dioksigenazlarning sirlari va mohiyati". Biokimyo va molekulyar biologiyaning tanqidiy sharhlari. 41 (4): 241–67. doi:10.1080/10409230600817422. PMID 16849108. S2CID 24145324.
- ^ Huang WC, Ellis J, Moody PC, Raven EL, Roberts GC (sentyabr, 2013). "Sitokrom p450 reduktaza katalitik tsiklida oksidlanish-qaytarilish bilan bog'liq domen harakatlari". Tuzilishi. 21 (9): 1581–9. doi:10.1016 / j.str.2013.06.022. PMC 3763376. PMID 23911089.
- ^ Vang M, Roberts DL, Paschke R, Shea TM, Masters BS, Kim JJ (Avgust 1997). "NADPH-sitoxrom P450 reduktaza uch o'lchovli tuzilishi: FMN va FAD o'z ichiga olgan fermentlar uchun prototip". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 94 (16): 8411–6. Bibcode:1997 PNAS ... 94.8411W. doi:10.1073 / pnas.94.16.8411. PMC 22938. PMID 9237990.
- ^ Sevrioukova IF, Li H, Zhang H, Peterson JA, Poulos TL (mart 1999). "Sitokrom P450-oksidlanish-qaytarilish sherigi elektron-uzatish kompleksining tuzilishi". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 96 (5): 1863–8. Bibcode:1999 yil PNAS ... 96.1863S. doi:10.1073 / pnas.96.5.1863. PMC 26702. PMID 10051560.
- ^ Tripati S, Li X, Poulos TL (iyun 2013). "P450 sitoxromida effektorni boshqarish va oksidlanish-qaytarilish sheriklarini aniqlashning tarkibiy asoslari". Ilm-fan. 340 (6137): 1227–30. Bibcode:2013 yil ... 340.1227T. doi:10.1126 / science.1235797. PMID 23744947. S2CID 23421892.
- ^ Hasemann CA, Kurumbail RG, Boddupalli SS, Peterson JA, Deisenhofer J (yanvar 1995). "P450 sitoxromlarining tuzilishi va funktsiyasi: uchta kristalli strukturaning qiyosiy tahlili". Tuzilishi. 3 (1): 41–62. doi:10.1016 / s0969-2126 (01) 00134-4. PMID 7743131.
- ^ Bugg TD, Rahmanpour R (dekabr 2015). "Ligninning qayta tiklanadigan kimyoviy moddalarga fermentativ konversiyasi". Kimyoviy biologiyaning hozirgi fikri. 29: 10–7. doi:10.1016 / j.cbpa.2015.06.009. PMID 26121945.
- ^ Bekxem GT, Jonson CW, Karp EM, Salvachua D, Vardon DR (dekabr 2016). "Biologik ligninni valorizatsiya qilishning imkoniyatlari va muammolari". Biotexnologiyaning hozirgi fikri. 42: 40–53. doi:10.1016 / j.copbio.2016.02.030. PMID 26974563.
- ^ Vardon DR, Franden MA, Jonson CW, Karp EM, Guarnieri MT, Linger JG va boshq. (2015). "Lignindan yog 'kislotasi ishlab chiqarish". Energiya va atrof-muhit fanlari. 8 (2): 617–628. doi:10.1039 / c4ee03230f. ISSN 1754-5692.
- ^ Lin L, Cheng Y, Pu Y, Sun S, Li X, Jin M va boshq. (2016). "Lignin konversiyalashning biologik konstruktsiyali biologik dizayni". Yashil kimyo. 18 (20): 5536–5547. doi:10.1039 / c6gc01131d. ISSN 1463-9262. OSTI 1326560.
