Fukuyama indol sintezi - Fukuyama indole synthesis
The Fukuyama indol sintezi vositachilik qiladigan ko'p qirrali kalaydir kimyoviy reaktsiya natijada 2,3-ajralgan shakllanishiga olib keladi indoles.[1] Ajratilgan indollarni yaratish uchun foydali bo'lishi mumkin bo'lgan bir martalik amaliy reaktsiya.[2] Eng keng tarqalgan tributiltin gidrid bilan kamaytiruvchi vosita sifatida ishlatiladi azobisisobutironitril (AIBN) radikal tashabbuskor sifatida. Trietilboran radikal tashabbuskor sifatida ham foydalanish mumkin.[3] Reaksiya ikkitadan boshlanishi mumkin orto-izosiyanostiren yoki 2-alkeniltioanilid lotin, ikkalasi ham indol hosil qiladi Radikal siklizatsiya orqali a-stannoimidoyl radikalidir.[4] R guruhi efir, THP efirlari va b-laktam kabi asosiy va kislotali sezgir funktsional guruhlarning bir qatori bo'lishi mumkin. Bundan tashqari, reaktsiya yo'q stereospetsifik, bunda ikkalasi ham cis va trans kerakli mahsulotni olish uchun izoformdan foydalanish mumkin.[5]

Mexanizm
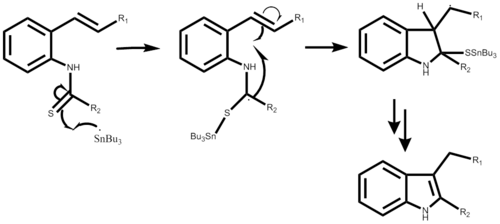
The reaktsiya mexanizmi Tributil qalay radikalini AIBN yoki trietilboran bilan hosil qilish bilan boshlanadi, har ikkala pog'onali mexanizmda ko'rsatilmagan. Radikal hujumlardan so'ng alfa-stannoimidoyl radikalini hosil qiluvchi o-izosiyano uglerod. Radikal siklizatsiya orqali beshta a'zoli halqa hosil bo'ladi, so'ngra yangi qalay radikal tarqaladi. Oxirgi bosqich reaktsiyaning kerakli natijasiga bog'liq. Bu reaktsiya a bitta qozon sintezi va natijada o'rnini bosuvchiga qarab hosil 50% dan 98% gacha.[1]

2-alkeniltioaniliddan foydalanish mexanizmi juda o'xshash, shuningdek, endi qalay radikal va oltingugurt o'rtasida bog'lanish hosil bo'lishidan boshlanadi. Xuddi shunday radikal siklizatsiya natijasida beshta a'zoli halqa paydo bo'ladi, yangi qalay radikal hosil bo'ladi va oltingugurt o'rnini bosuvchi dastlabki hujum qiluvchi radikal barglar paydo bo'ladi. Bosqichli mexanizmning ushbu qismi hali batafsil bayon qilinmagan. Reaksiya rentabelligi kerakli substituentga qarab 40% dan 93% gacha bo'lishi mumkin.
Hosilalari
Fukuyama indol sintezi 2,3 holatida bir qator turli xil o'rnini bosuvchi vositalarni yaratishi mumkin edi, ular ilgari himoya guruhi halqadagi azot ustida. Bunday misollardan biri 2-yodoindol hosilasi bo'lib, keyinchalik turli xil N-himoyalanmagan 2,3 o'rnini bosgan indollarga olib kelishi mumkin. Ushbu birikma topilishidan oldin 2-stanilindollarni o'z ichiga olgan kimyo rivojlanmagan, chunki bu N-himoyalanmagan 2,3-stannilindollarni amalda sintez qilishning iloji yo'q edi. Ulardan biri N-himoyalangan 2-stanilindollarni ishlab chiqarish bilan cheklangan metalllash sifatida tanilgan jarayon bilan Stil bilan bog'lanish.[6] Fukuyama sintezidan hosil bo'lgan N-himoyalanmagan 2-stanilindollar yod bilan oson oksidlanishi mumkin, bu esa kimyo sohasini ochadi, bu esa 2-yodoindollardan boshlang'ich reaktiv sifatida foydalanadigan turli xil birikmalarni sintez qilishga imkon beradi. Ushbu yod bilan almashtirilgan lotin aril galogenidlar, vinil yodidlar, vinil triflatlar, benzil bromidlarga olib kelishi mumkin.

Asetilenlarga qo'shimcha ravishda (Sonogashira birikmasi ) va akrilatlar (Hek reaktsiyasi ) ikkinchi pozitsiyada.[5]

Ilovalar
Sintez - bu poli-o'rnini bosuvchi indollarni yaratishning eng oddiy usullaridan biri bo'lib, ushbu protsedura ko'plab qo'llanilgan tabiiy mahsulot sintezlar, shu jumladan aspidofitin,[7] vinblastin,[8] va strixnin[9]
Quyida (+) - Vinblastin sintezidagi to'rtinchi bosqich, Fukuyama Indol sintezini ajratilgan indol hosil qilish uchun qo'llash ko'rsatilgan.

Bundan tashqari, fukuyama reaktsiyasi indolokarbazollarning sintezida rol o'ynaydi,[5] bindolil,[5] va ning umumiy sintezi vinkadifformin va tabersonine.[10]
Adabiyotlar
- ^ a b Fukuyama, T .; Chen, X .; Peng, G. (1994). "Roman qalay vositachiligidagi indol sintezi". J. Am. Kimyoviy. Soc. 116 (7): 3127–8. doi:10.1021 / ja983681v.
- ^ Pindur, U .; Adam, R. (1998). "Sintetik jozibali indolizatsiya jarayonlari va tanlab almashtirilgan indollarni tayyorlashning yangi usullari". J. Heterotsikl. Kimyoviy. 25 (1): 1–8. doi:10.1002 / jhet.5570250101.
- ^ Tokuyama, X .; Yamashita, T .; Reding, M. T .; Kaburagi, Y .; Fukuyama, T. (1999). "2-alkeniltioanilidlarning tubdan siklizatsiyasi: 2,3 ta almashtirilgan indollarning roman sintezi". J. Am. Kimyoviy. Soc. 121 (15): 3791–2. doi:10.1021 / ja983681v.
- ^ Gribble, G. (2000). "Indol halqa sintezidagi so'nggi o'zgarishlar - metodologiya va qo'llanmalar". J. Chem. Soc. Perkin Trans. 1. 2000 (7): 1045–75. doi:10.1039 / a909834 soat.
- ^ a b v d Kobayashi, T .; Fukuyama, T. (1998). "Yangi indol sintezini ishlab chiqish". J. Heterotsikl. Kimyoviy. 35 (5): 1043–56. doi:10.1002 / jhet.5570350504.
- ^ Trost, B. M .; Fortunak, J. M. (1982). "Pd tomonidan boshlangan siklizatsiyalar2+-Ag+ aralash metall tizim ". Organometalik. 1 (7): 7–10. doi:10.1021 / om00061a003.
- ^ Sumi, S .; Matsumoto, K .; Tokuyama, X .; Fukuyama, T. (2003). "Aspidofitinning enantiyoselektiv total sintezi". Org. Lett. 5 (11): 1891–3. doi:10.1021 / ol034445e. PMID 12762679.
- ^ Yokoshima, S .; Ueda, T .; Kobayashi, S .; Sato, A .; Kuboyama, T .; Tokuyama, X .; Fukuyama, T. (2002). "(+) - Vinblastinning stereokontrolli total sintezi". J. Am. Kimyoviy. Soc. 124 (10): 2137–9. CiteSeerX 10.1.1.414.6638. doi:10.1021 / ja0177049. PMID 11878966.
- ^ Kaburagi, Y .; Tokuyama, X .; Fukuyama, T. (2004). "(-) - Strixninning umumiy sintezi". J. Am. Kimyoviy. Soc. 126 (33): 10246–7. doi:10.1021 / ja046407b. PMID 15315428.
- ^ Kobayashi, S .; Peng, G.; Fukuyama, T. (1999). "(±) -vinkadifformin va (-) - tabersoninning samarali umumiy sintezlari". Tetraedr Lett. 40 (8): 1519–22. doi:10.1016 / S0040-4039 (98) 02667-7.
