Fosfor pentasulfid - Phosphorus pentasulfide
 | |
 | |
| Ismlar | |
|---|---|
| Boshqa ismlar fosfor sulfidi oltingugurt fosfidi fosfor persulfidi difosfor pentasulfid tetrafosfor dekasulfid fosfor dekasulfidi | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.013.858 |
| EC raqami |
|
PubChem CID | |
| RTECS raqami |
|
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| P2S5 yoki dimer P4S10 | |
| Molyar massa | 222,27 g mol |
| Tashqi ko'rinishi | yashil-kulrangdan sariq ranggacha qattiq[1] |
| Hidi | chirigan tuxum[1] |
| Zichlik | 2,09 g / sm3 |
| Erish nuqtasi | 288 ° C (550 ° F; 561 K) |
| Qaynatish nuqtasi | 514 ° C (957 ° F; 787 K) |
| gidrolizlar | |
| Eriydiganlik boshqa erituvchilarda | 0,222 g / 100g CS2 (17 ° C da) Erimaydi C6H6 Issiq ksilenda erimaydi Issiqda erimaydi anisol. |
| Bug 'bosimi | 1 mm simob ustuni (300 ° C)[1] |
| Tuzilishi | |
| triklinika, aP28 | |
| P-1, № 2 | |
| Td | |
| Xavf | |
| O'lim dozasi yoki konsentratsiyasi (LD, LC): | |
LD50 (o'rtacha doz ) | 389 mg / kg (og'iz, kalamush)[2] |
| NIOSH (AQSh sog'lig'iga ta'sir qilish chegaralari): | |
PEL (Joiz) | TWA 1 mg / m3[1] |
REL (Tavsiya etiladi) | TWA 1 mg / m3 ST 3 mg / m3[1] |
IDLH (Darhol xavf) | 250 mg / m3[1] |
| Tegishli birikmalar | |
Tegishli birikmalar | P4S3 |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Fosfor pentasulfid bo'ladi noorganik birikma formula bilan P2S5 yoki dimer P4S10. Ushbu sariq qattiq narsa ikkitadan biridir fosfor sulfidlari tijorat qiymati. Namunalar iflosliklar tufayli ko'pincha yashil-kulrang ko'rinadi. U uglerod disulfidda eriydi, ammo spirtli ichimliklar, DMSO va DMF kabi ko'plab boshqa erituvchilar bilan reaksiyaga kirishadi.[3]
Tuzilishi va sintezi
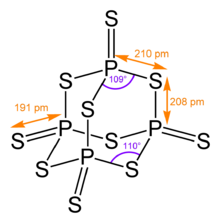
Uning tetraedral molekulyar tuzilishi shunga o'xshash adamantane va tuzilishi bilan deyarli bir xil fosfor pentoksidi.[4]
Fosfor pentasulfid suyuqlik reaktsiyasi natijasida olinadi oq fosfor (P4) bilan oltingugurt 300 ° C dan yuqori. P ning birinchi sintezi4S10 tomonidan Berzeliy 1843 yilda [5][6] ushbu usul bo'yicha edi. Shu bilan bir qatorda, P4S10 elementar oltingugurt yoki reaksiyaga kirishish natijasida hosil bo'lishi mumkin pirit, FeS2, bilan ferrofosfor, Fe ning xom shakli2P (yon mahsulot P4 dan ishlab chiqarish fosfat jinsi ):
- 4 Fe2P + 18 S → P4S10 + 8 FeS
- 4 Fe2P + 18 FeS2 + issiqlik → P4S10 + 26 FeS
Ilovalar
Taxminan 150 ming tonna P4S10 har yili ishlab chiqariladi. Murakkab, asosan, soqol qo'shimchalari sifatida foydalanish uchun boshqa hosilalarga aylantiriladi rux ditiofosfatlar. Bu ishlab chiqarishda keng qo'llaniladi natriy ditiofosfat molibdenit minerallari kontsentratsiyasida flotatsion vosita sifatida qo'llanilishi uchun. Kabi pestitsidlarni ishlab chiqarishda ham foydalaniladi Paration va Malation.[7] Shuningdek, u ba'zi bir amorf qattiq moddalarning tarkibiy qismidir elektrolitlar (masalan, Li2S-P2S5) ba'zi turlari uchun lityum batareyalar.
Fosfor pentasulfid - bu a ikkilamchi foydalanish Amiton kabi erta insektitsidlarni ishlab chiqarish uchun va shu bilan bog'liq bo'lganlarni ishlab chiqarish uchun material VX asab agentlari.
Reaktivlik
Atmosfera namligi bilan gidroliz tufayli P4S10 rivojlanadi H2S, shunday qilib P4S10 chirigan tuxum hidi bilan bog'liq. H dan tashqari2S, gidroliz P ning4S10 oxir-oqibat beradi fosfor kislotasi:
- P4S10 + 16 H2O → 4 H3PO4 + 10 H2S
Boshqa yumshoq nukleofillar P bilan reaksiyaga kirish4S10, shu jumladan spirtli ichimliklar va ominlar. Kabi aromatik birikmalar anisol, ferrosen va 1-metoksinaftalin shaklga reaktsiya 1,3,2,4-dityadifosfetan 2,4-disulfidlar kabi Lawessonning reaktivi.
P4S10 sifatida ishlatiladi thionation reaktiv. Ushbu turdagi reaktsiyalar, masalan, qaytaruvchi erituvchilarni talab qiladi benzol, dioksan, yoki asetonitril P bilan4S10 P ga ajraladi2S5. Ba'zi ketonlar, esterlar va imidlar tegishli tiokarbonillarga aylanadi. Amidlar berish tioamid. 1,4-diketonlar bilan reaktiv shakllari tiofenlar. U sulfoksidlarni oksidlanishsizlantirish uchun ham ishlatiladi. P dan foydalanish4S10 tomonidan ko'chirilgan Lawessonning reaktivi P4S10s.[8]
P2S5 bilan reaksiyaga kirishadi piridin kompleks P hosil qilish uchun2S5(piridin)2.[9]
Adabiyotlar
- ^ a b v d e f Kimyoviy xavf-xatarlarga qarshi NIOSH cho'ntak qo'llanmasi. "#0510". Mehnatni muhofaza qilish milliy instituti (NIOSH).
- ^ "Fosfor pentasulfid". Darhol hayot va sog'liq uchun kontsentratsiyalar xavfli (IDLH). Mehnatni muhofaza qilish milliy instituti (NIOSH).
- ^ Skott D. Edmondson, Musumi Sannigrahi "Fosfor (V) sulfid" "Organik sintez uchun reaktivlar entsiklopediyasi" 2004 yil Jon Vili va o'g'illari. doi:10.1002 / 047084289X.rp166s.pub2
- ^ Corbridge, D. E. C. (1995). Fosfor: uning kimyo, biokimyo va texnologiyasining qisqacha bayoni (5-nashr). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- ^ Berzelius, J. (1843). "Ueber Verbindungen des Phosphors mit Schwefel die". Annalen der Chemie und Pharmacie. 46 (2): 129–154. doi:10.1002 / jlac.18430460202.
- ^ Berzelius, J. (1843). "Ueber Verbindungen des Phosphors mit Schwefel die". Annalen der Chemie und Pharmacie. 46 (3): 251–281. doi:10.1002 / jlac.18430460303. (xuddi shu jildning 154-betining davomi)
- ^ Bettermann, G.; Krause, V.; Ress, G.; Hofmann, T. (2002). "Fosfor aralashmalari, noorganik". Ullmannning Sanoat kimyosi ensiklopediyasi. Vaynxaym: Vili-VCH. doi:10.1002 / 14356007.a19_527. ISBN 3527306730.
- ^ Ozturk, T .; Ertas, E .; Mert, O. (2010). "Berzeliy reaktivi, fosfor dekasulfidi (P4S10), Organik sintezda ". Kimyoviy sharhlar. 110 (6): 3419–3478. doi:10.1021 / cr900243d. PMID 20429553.
- ^ Bergman, Jan; Pettersson, Birgitta; Xasimbegovich, Vedran; Svensson, Per H. (2011). "Asetonitril va dimetil sulfon kabi erituvchilarda P4S10 − piridin kompleksidan foydalangan holda tionlanishlar". Organik kimyo jurnali. 76 (6): 1546–1553. doi:10.1021 / jo101865y. PMID 21341727.
