Piruvat dehidrogenaza - Pyruvate dehydrogenase
| piruvat dehidrogenaza (atsetil o'tkazuvchi) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Piruvat dehidrogenaza (PDH) ning kristalografik tuzilishi. PH oltita domen dimeridir, u a (ko'k), a '(sariq), b (qizil) va g' (choy) hududlari bilan turli xil ranglar bilan belgilanadi. Tiamin pirofosfat (TPP) kulrang shar va tayoq shaklida, ikkita magniy ioni TPP bilan metall bog'lash jarayonida binafsha rangda va ikkita kaliy ioni to'q sariq rangda ko'rsatilgan.[1] | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 1.2.4.1 | ||||||||
| CAS raqami | 9014-20-4 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Piruvat dehidrogenaza bu ferment piruvat reaktsiyasini katalizlovchi va a lipoamid atsetillangan dihidrolipoamidni berish va karbonat angidrid. Konvertatsiya qilish uchun koenzim tiamin pirofosfat.
Piruvat dehidrogenaza odatda E1 deb ataladigan komponent sifatida uchraydi piruvat dehidrogenaza kompleksi (PDC). PDC E2 va E3 deb ataladigan boshqa fermentlardan iborat. Umumiy holda E1-E3 konvertatsiyasi piruvat, NAD+, koenzim A ichiga kiradi atsetil-KoA, CO2va NADH. O'tkazish juda muhimdir, chunki keyinchalik atsetil-KoA dan foydalanish mumkin limon kislotasining aylanishi amalga oshirish uyali nafas olish.[2]. Ushbu ferment va PDC o'rtasidagi farqni aniqlash uchun u muntazam ravishda chaqiriladi piruvat dehidrogenaza (atsetil o'tkazuvchi).
Mexanizm

Tiamin pirofosfat (TPP) deprotonatsiya bilan ilidga aylanadi. Ylide piruvatning keton guruhiga hujum qiladi. Olingan qo'shimcha dekarboksilatlar. Olingan 1,3-dipol reduktiv ravishda lipoamid-E2 asetilat qiladi.[2]
Tafsilotlar nuqtai nazaridan, E1 uchun biokimyoviy va tarkibiy ma'lumotlar TPP koenzimining glutamat qoldig'i bilan saqlanib qolgan vodorod bog'lanishini hosil qilish (inson E1 tarkibidagi Glu59) va aminopirimidinning N4 'atomini keltirib chiqaradigan V konformatsiyasini o'rnatish orqali TPP koenzimini faollashtirish mexanizmini aniqladi. tiazolium C2 atomi bilan molekula ichidagi vodorod bog'lanishiga. Ushbu noyob aloqa va TPP konformatsiyalarining kombinatsiyasi, oxir-oqibat, reaktiv C2-karbanion hosil bo'lishiga olib keladi. CoPactor TPP dekarboksilatlaridan keyin piruvat, atsetil qismi TPPga kovalent ravishda biriktirilgan gidroksietil hosilaga aylanadi.[1]
Tuzilishi
E1 multimerik oqsil hisoblanadi. Sutemizuvchilar E1lari, shu jumladan inson E1, ikkita a- va ikkita b- subbirliklardan tashkil topgan tetramerikdir.[1] Ba'zi bakterial E1lar, shu jumladan E1 dan Escherichia coli, ikkita o'xshash subbirlikdan iborat bo'lib, ularning har biri a- va b- subbirliklarining molekulyar massalari yig'indisi kabi katta.[3]
.
Faol sayt
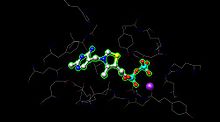
E1 ikkita katalitik maydonga ega, ularning har biri ta'minlanadi tiamin pirofosfat (IES ) va kofeaktor sifatida magniy ioni. A- subbirlik magnezium ioni va pirofosfat bo'lagini, b-subbirlik esa pirimidin bo'lagini bog'laydi. IES, subbirliklarning interfeysida katalitik sayt hosil qiladi.[1]
The faol sayt piruvat dehidrogenaza uchun (yaratilgan rasm PDB: 1NI4) Magniy ioniga (binafsha shar) metall bog'lash va aminokislotalarga vodorod bog'lash orqali TPPni ushlab turadi. Faol joylarda 20 dan ortiq aminokislotalarni topish mumkin bo'lsa, Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 va Uning 263 aminokislotalari vodorod birikishida ishtirok etadi. Faol saytda TPP va piruvat (bu erda ko'rsatilmagan). Aminokislotalar simlar shaklida, TPP esa shar shaklida va tayoqcha shaklida bo'ladi. Faol sayt, shuningdek, TPPdagi asilni E2 da kutib turgan lipoamidga o'tkazishda yordam beradi.[1]
Tartibga solish
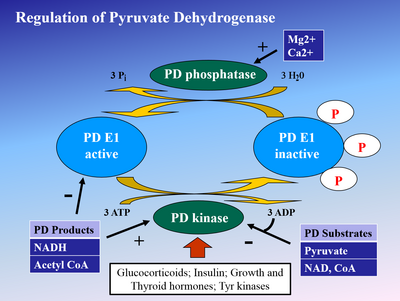
Fosforillanish E1 tomonidan piruvat dehidrogenaza kinaz (PDK) E1 ni va keyinchalik butun kompleksni inaktiv qiladi. PDK tomonidan inhibe qilinadi dikloroasetik kislota va piruvat, natijada faol, fosforlanmagan PDH miqdori ko'proq bo'ladi.[4] Fosforilaton tomonidan teskari yo'naltirilgan piruvat dehidrogenaza fosfataza tomonidan rag'batlantiriladi insulin, PEP va AMP, lekin raqobatbardosh ravishda inhibe qilinadi ATP, NADH va Asetil-KoA.
Patologiya
Piruvat dehidrogenaza an tomonidan yo'naltirilgan autoantigen anti-mitoxondrial antikorlar (AMA) deb nomlanadi, bu esa jigarning kichik o't yo'llarining izchil yo'q qilinishiga olib keladi va natijada birlamchi biliar sirroz. Ushbu antikorlar oksidlangan oqsilni taniydi, bu yallig'lanishli immunitet reaktsiyalaridan kelib chiqadi. Ushbu yallig'lanish reaktsiyalarining ba'zilari bilan bog'liq bo'lishi mumkin kleykovina sezgirligi chunki bitta tadqiqotda o'tkir jigar etishmovchiligining 50% dan ko'prog'i a nonmitoxondriyal avtoantikor to'qimalarga qarshi transglutaminaza.[5] Boshqa mitoxondriyal otoantikanlar kiradi oksoglutarat dehidrogenaza va tarvaqaylab zanjirli alfa-keto kislota dehidrogenaza kompleksi tomonidan tan olingan antijenlerdir mitoxondriyaga qarshi antikorlar.
Piruvat dehidrogenaza (PDH) etishmovchiligi - bu X xromosomasida joylashgan piruvat dehidrogenaza kompleksi (PDC) mutatsiyasidan kelib chiqqan tug'ma degenerativ metabolik kasallik. Kompleksning barcha 3 fermentida nuqsonlar aniqlangan bo'lsa, E1-a subbirligi asosan aybdor. PDH etishmovchiligi sababli limon kislotasi tsiklining noto'g'ri ishlashi tanani energiyadan mahrum qiladi va laktatning g'ayritabiiy birikmasiga olib keladi. PDH etishmovchiligi yangi tug'ilgan chaqaloqlarda laktik atsidozning keng tarqalgan sababidir va ko'pincha og'ir letargiya, yomon ovqatlanish, taxipniya va o'lim holatlari bilan kechadi.[6]
Misollar
Piruvat dehidrogenaza faolligiga ega bo'lgan inson oqsillariga quyidagilar kiradi.
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bilan bog'liq fermentlar
Yilda bakteriyalar, piruvatning atsetat va karbonat angidridga oksidlanishini ferrotsitxromning kamayishi bilan bog'laydigan piruvat dehidrogenaza shakli (shuningdek, piruvat oksidaza, EC 1.2.2.2) mavjud. Yilda E. coli bu ferment kodlangan xurmo B. gen va oqsil flavin kofaktoriga ega.[7] Ushbu ferment o'sish samaradorligini oshiradi E. coli aerobik sharoitda.[8]
Shuningdek qarang
Adabiyotlar
- ^ a b v d e PDB: 1ni4; Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS (iyun 2003). "Inson piruvat dehidrogenazasi tomonidan aniqlangan tiamin pirofosfatga bog'liq fermentlarning flip-flop ta'sirining strukturaviy asoslari". J. Biol. Kimyoviy. 278 (23): 21240–6. doi:10.1074 / jbc.M300339200. PMID 12651851.
- ^ a b J. M. Berg; J. L. Timoczko, L. Strayer (2007). Biokimyo (6 nashr). Freeman. ISBN 978-0-7167-8724-2.CS1 maint: bir nechta ism: mualliflar ro'yxati (havola)
- ^ Arjunan P, Nemeria N, Brunskill A, Chandrasekhar K, Sax M, Yan Y va boshq. (2002 yil aprel). "Escherichia coli-dan 1,85 A piksellar sonidagi piruvat dehidrogenaza ko'p fermentli kompleks E1 komponentining tuzilishi". Biokimyo. 41 (16): 5213–21. doi:10.1021 / bi0118557. PMID 11955070.
- ^ Jaimes, R 3rd (Jul 2015). "Izolyatsiya qilingan, perfuzlangan normoksik yurakning piruvat dehidrogenazni dikloroasetat va piruvat bilan faollashuviga funktsional javobi". Pflygers Arch. 468 (1): 131–42. doi:10.1007 / s00424-015-1717-1. PMC 4701640. PMID 26142699.
- ^ Leung PS, Rossaro L, Devis PA, va boshq. (2007). "O'tkir jigar etishmovchiligida antititondriyal antikorlar: birlamchi biliar sirrozga ta'siri". Gepatologiya. 46 (5): 1436–42. doi:10.1002 / hep.21828. PMC 3731127. PMID 17657817.
- ^ Piruvat dehidrogenaza kompleksining etishmasligi da eTibbiyot
- ^ Recny MA, Hager LP (1982). "Mahalliyni qayta tiklash Escherichia coli apoferment monomerlari va FAD dan piruvat oksidaza ". J. Biol. Kimyoviy. 257 (21): 12878–86. PMID 6752142.
- ^ Abdel-Xamid AM, Attvud MM, Mehmon JR (2001). "Piruvat oksidaza aerob o'sish samaradorligiga hissa qo'shadi Escherichia coli". Mikrobiologiya. 147 (Pt 6): 1483-98. doi:10.1099/00221287-147-6-1483. PMID 11390679.
- Ochoa S (1954). "Limon kislotasi siklidagi ferment mexanizmlari". Enzimologiya va molekulyar biologiyaning tegishli sohalaridagi yutuqlar. Enzimologiya yutuqlari va biokimyoning tegishli fanlari. Enzimologiya yutuqlari - va molekulyar biologiyaning tegishli sohalari. 15. 183-270 betlar. doi:10.1002 / 9780470122600.ch5. ISBN 9780470122600. PMID 13158180.
- Scriba P, Xolzer H (1961). "Gewinnung von alphaHydroxyathyl-2-tiaminpyrophosphat mit Pyruvatoxydase aus Schweineherzmuskel". Biokimyo. Z. 334: 473–486.
- Perham RN (2000). "Ko'p funktsiyali fermentlarda silkitadigan qo'llar va tebranuvchi domenlar: ko'p bosqichli reaktsiyalar uchun katalitik mashinalar". Biokimyo fanining yillik sharhi. 69 (1): 961–1004. doi:10.1146 / annurev.biochem.69.1.961. PMID 10966480.
Tashqi havolalar
- Piruvat + Dehidrogenaza-E1 AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
- http://www.brookscole.com/chemistry_d/templates/student_resources/shared_resources/animations/pdc/pdc.html
- PDBe-KB inson piruvat dehidrogenazasi (lipoamid) alfa 1 uchun PDB-da mavjud bo'lgan barcha tuzilish ma'lumotlari haqida umumiy ma'lumot beradi.
- PDBe-KB PDB-da mavjud bo'lgan barcha tuzilish ma'lumotlari haqida ma'lumot beradi inson piruvat dehidrogenazasi (lipoamid) beta uchun.
ATP ADP ATP ADP + + 2 ×  2 ×  2 × 3-fosfogliserat 2 ×  2 × 2-fosfogliserat 2 ×  2 × Fosfoenolpiruvat 2 ×  ADP ATP 2 × Piruvat 2 × |





