Piruvat dehidrogenaza kompleksi - Pyruvate dehydrogenase complex - Wikipedia

Piruvat dehidrogenaza kompleksi (PDC) uchtadan iborat kompleks fermentlar o'zgartiradi piruvat ichiga atsetil-KoA deb nomlangan jarayon bilan piruvat dekarboksilatsiyasi.[1] Asetil-CoA ni keyinchalik ishlatilishi mumkin limon kislotasining aylanishi amalga oshirish uyali nafas olish va bu kompleks bog'langan glikoliz metabolik yo'l uchun limon kislotasining aylanishi. Piruvatning dekarboksillanishi "piruvat dehidrogenaza reaktsiyasi" deb ham ataladi, chunki u piruvatning oksidlanishini ham o'z ichiga oladi.[2]
Ushbu ko'p fermentli kompleks strukturaviy va funktsional jihatdan oksoglutarat dehidrogenaza va tarvaqaylab zanjirli okso-kislotali dehidrogenaza ko'p fermenti komplekslar.
Reaksiya
Piruvat dehidrogenaza kompleksi tomonidan katalizlanadigan reaktsiya:
| piruvat | piruvat dehidrogenaza kompleksi | atsetil CoA | |
 |  | ||
| CoA-SH + NAD+ | CO2 + NADH + H+ | ||
 | |||
Tuzilishi
| Fermentlar | Qisqartma. | Kofaktorlar | # subbirlik prokaryotlari | # subkoditsiya eukaryotlar |
|---|---|---|---|---|
| piruvat dehidrogenaza (EC 1.2.4.1 ) | E1 | IES (tiamin pirofosfat) | 24 | 30 |
| dihidrolipoyl transatsetilaza (EC 2.3.1.12 ) | E2 | lipoat koenzim A | 24 | 60 |
| dihidrolipoyl dehidrogenaza (EC 1.8.1.4 ) | E3 | FAD NAD+ | 12 | 12 |
Piruvat dehidrogenaza (E1)
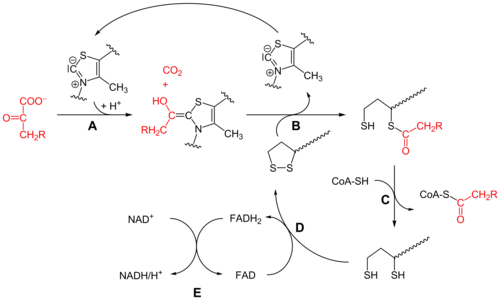
Dastlab, piruvat va tiamin pirofosfat (IES yoki B vitamini1 ) bilan bog'langan piruvat dehidrogenaza subbirliklar.[1] The tiazolium IESning halqasi a zvitterionik shakli va anionik C2 uglerodi piruvatning C2 (keton) karboniliga nukleofil hujumini amalga oshiradi. Natijada paydo bo'lgan gemitioatsetal o'tadi dekarboksilatsiya asil anion ekvivalenti ishlab chiqarish uchun (qarang siyanohidrin yoki aldegid-ditian umpolung kimyo, shuningdek benzoin kondensatsiyasi ). Ushbu anion a ga biriktirilgan oksidlangan lipoat turining S1 ga hujum qiladi lizin qoldiq. Ringni ochishda SN2 o'xshash mexanizm, S2 sulfid yoki sulfhidril bo'lagi sifatida siljiydi. Keyinchalik tetraedral gemitioatsetal qulashi tiazolni chiqarib tashlaydi, TPP kofaktorini chiqarib yuboradi va S1 lipoatda tioatsetat hosil qiladi. E1-katalizlangan jarayon butun piruvat dehidrogenaza kompleksining tezlikni cheklash bosqichidir.
Dihidrolipoyl transatsetilaza (E2)
Ushbu nuqtada lipoat-tioester funktsionalligi dihidrolipoyl transatsetilaza (E2) faol sayt,[1] bu erda transatsilatsiya reaktsiyasi atsetilni lipoylning "tebranadigan qo'lidan" tiolga o'tkazadi. koenzim A. Bu ishlab chiqaradi atsetil-KoA, u fermentlar kompleksidan ajralib chiqadi va keyinchalik ichiga kiradi limon kislotasining aylanishi. E2 ni lipoamid reduktaza-transatsetilaza deb ham atash mumkin.
Dihidrolipoyl dehidrogenaza (E3)
The dihidrolipoat, hanuzgacha majmuaning lizin qoldig'iga bog'lanib, so'ngra dihidrolipoyl dehidrogenaza (E3) faol sayt,[1] qaerda u a flavin -kimyoviy bilan bir xil bo'lgan oksidlanish disulfid izomerazasi. Birinchidan, FAD dihidrolipoatni yana lipoatning tinchlanish holatiga qaytaradi va FADH hosil qiladi2. Keyin, a NAD+ kofaktor FADHni oksidlaydi2 NADH ishlab chiqaradigan FAD dam olish holatiga qaytadi.
Turlar orasidagi tarkibiy farqlar
PDC - bu turlarga qarab 3 yoki 4 subbirlikning bir nechta nusxalaridan tashkil topgan katta kompleks.
Gram-manfiy bakteriyalar
Yilda Gram-manfiy bakteriyalar, masalan. Escherichia coli, PDC 24 molekuladan tashkil topgan markaziy kubik yadrodan iborat dihidrolipoyl transatsetilaza (E2) .24 nusxaga qadar piruvat dehidrogenaza (E1) va ning 12 molekulasi dihidrolipoyl dehidrogenaza (E3) E2 yadrosining tashqi tomoniga bog'lanadi.[3]
Gram-musbat bakteriyalar va eukaryotlar
Aksincha, ichida Gram-musbat bakteriyalar (masalan, Bacillus stearothermophilus ) va eukaryotlarda markaziy PDC yadrosi ikosaedrga joylashtirilgan 60 ta E2 molekulasini o'z ichiga oladi.
Eukaryotlar tarkibida qo'shimcha yadro oqsilining 12 nusxasi, E3 bog'laydigan oqsil (E3BP). E3BP ning aniq joylashuvi to'liq aniq emas. Kriyo-elektron mikroskopi E3BP ning xamirturush ichidagi har bir ikosaedral yuz bilan bog'lanishini aniqladi.[4] Shu bilan birga, u sigir PDC yadrosidagi teng miqdordagi E2 molekulalarini almashtiradi deb taxmin qilingan.
60 ga qadar E1 yoki E3 molekulalari Gram-musbat bakteriyalardan E2 yadrosi bilan birikishi mumkin - bog'lanish o'zaro bog'liqdir. Eukaryotlarda E1 maxsus E2 bilan bog'langan, E3 esa E3BP bilan bog'langan. Molekulalarning aniq soni o'zgarishi mumkin bo'lsa-da, 30 E1 va 6 E3 fermentlari mavjud deb o'ylashadi. jonli ravishda va ko'pincha ko'rib chiqilayotgan to'qimalarning metabolik talablarini aks ettiradi.
Tartibga solish
Piruvat dehidrogenaza quyidagi uchta nisbatdan biri yoki bir nechtasi oshganda inhibe qilinadi: ATP /ADP, NADH / NAD+ va atsetil-KoA /CoA.
Eukaryotlarda PDC o'ziga xos xususiyatlar bilan qat'iy tartibga solinadi piruvat dehidrogenaza kinaz (PDK) va piruvat dehidrogenaza fosfataza (PDP), uni mos ravishda o'chirish va faollashtirish.[5]
- PDK fosforilatlar uchta aniq serin turli xil yaqinliklarga ega bo'lgan E1 qoldiqlari. Ulardan birortasining fosforillanishi (foydalanish ATP ) E1 ni (va natijada butun majmuani) harakatsiz qiladi.[5]
- Deposforillanish PD1 tomonidan E1 ning murakkab faoliyati tiklanadi.[5]
Reaksiya mahsulotlari quyidagicha harakat qiladi allosterik ingibitorlari PDC-ni, chunki ular PDK-ni faollashtiradi. Substratlar o'z navbatida PDKni inhibe qiladi, PDCni qayta faollashtiradi.
Davomida ochlik, PDK ko'pgina to'qimalarda, shu jumladan, ko'payadi skelet mushaklari, oshdi orqali gen transkripsiyasi. Xuddi shu sharoitda PDP miqdori kamayadi. Natijada paydo bo'lgan PDC inhibatsiyasi mushak va boshqa to'qimalarni glyukoza va katabolizmdan saqlaydi glyukoneogenez kashshoflar. Metabolizm tomon siljiydi yog'dan foydalanish, glyukoneogenez prekursorlarini etkazib berish uchun mushak oqsilining parchalanishi minimallashtiriladi va mavjud bo'lgan glyukoza miya.
Kaltsiy ionlari mushak to'qimalarida PDCni boshqarishda muhim rol o'ynaydi, chunki u PDPni faollashtiradi, stimulyatsiya qiladi glikoliz uning sitozolga chiqarilishi to'g'risida - davomida mushaklarning qisqarishi. Ushbu transkriptsiyalarning ayrim mahsulotlari mushaklarga H2 ni chiqaradi. Bu vaqt o'tishi bilan kaltsiy ionlarining parchalanishiga olib kelishi mumkin.
Piruvat dekarboksilatsiyasining lokalizatsiyasi
Yilda ökaryotik hujayralar piruvat dekarboksilatsiyasi mitoxondriyal matritsa ichida, piruvat substratni tashishdan keyin sitozol. Piruvatning mitoxondriyaga o'tishi transport oqsili piruvat translokaza. Piruvat translokaza piruvatni simport tarzida proton bilan tashiydi va shuning uchun ham shunday bo'ladi faol, iste'mol energiya.[iqtibos kerak ]. Shu bilan bir qatorda manbalar "piruvatni tashqi mitoxondriyal membrana orqali tashish katta selektiv bo'lmagan kanallar orqali osonlikcha amalga oshirilgan ko'rinadi. kuchlanishga bog'liq anion kanallari, passiv diffuziyani ta'minlovchi "va ichki mitoxondriyal membrana orqali tashish mitokondriyal piruvat tashuvchisi 1 (MPC1) va mitoxondriyal piruvat tashuvchisi 2 (MPC2) [6].
Mitoxondriyaga kirishda piruvat dekarboksillanadi va atsetil-KoA hosil qiladi. Ushbu qaytarib bo'lmaydigan reaktsiya atsetil-KoA mitoxondriya ichida (atsetil-KoA mitoxondriyal matritsadan faqat yuqori oksaloatsetat sharoitida sitrat moki orqali, odatda siyrak bo'lgan TCA oralig'i orqali ko'chirilishi mumkin). Ushbu reaktsiya natijasida hosil bo'lgan karbonat angidrid qutbsiz mitoxondriyadan va hujayradan tarqalishi mumkin.
Yilda prokaryotlar mitoxondriyasi bo'lmagan, bu reaksiya sitosolda amalga oshiriladi yoki umuman bo'lmaydi.
Klinik ahamiyati
Piruvat dehidrogenaza etishmovchiligi fermentlarning yoki kofaktorlarning har qanday mutatsiyasidan kelib chiqishi mumkin. Uning asosiy klinik xulosasi sut kislotasi.[7]
Shuningdek qarang
Adabiyotlar
- ^ a b v d DeBros, Suzanna D.; Kerr, Duglas S. (2016-01-01), Saneto, Rassel P.; Parix, Sumit; Koen, Bryus H. (tahr.), "12-bob - Piruvat dehidrogenaza kompleksining etishmasligi", Mitokondriyal holatlar bo'yicha tadqiqotlar, Boston: Academic Press, 93-101 betlar, doi:10.1016 / b978-0-12-800877-5.00012-7, ISBN 978-0-12-800877-5, olingan 2020-11-16
- ^ J. M. Berg; J. L. Timoczko, L. Strayer (2007). Biokimyo (6 nashr). Freeman. ISBN 978-0-7167-8724-2.CS1 maint: bir nechta ism: mualliflar ro'yxati (havola)
- ^ Izard T, Aevarsson A, Allen MD, Westphal AH, Perham RN, de Kok A, Hol WG (1999). "Kvazi ekvivalentlik printsiplari va Evklid geometriyasi piruvat dehidrogenaza komplekslarining kubik va dodekaedral yadrolarini yig'ilishini boshqaradi". Proc. Natl. Akad. Ilmiy ish. AQSH. 96 (4): 1240–1245. Bibcode:1999 yil PNAS ... 96.1240I. doi:10.1073 / pnas.96.4.1240. PMC 15447. PMID 9990008. [1]
- ^ Stoops, JK, Cheng, RH, Yazdi, MA, Maeng, CY, Schroeter, JP, Klueppelberg, U., Kolodziej, SJ, Baker, TS, Reed, LJ (1997) Saccharomyces cerevisiae piruvat dehidrogenazasining noyob tarkibiy tashkiloti to'g'risida. murakkab. J. Biol. Kimyoviy. 272, 5757-5764.
- ^ a b v Pelli, Jon V. (2012-01-01), Pelli, Jon V. (tahrir), "6 - Glikoliz va piruvatning oksidlanishi", Elsevierning Integrated Review Biokimyo (Ikkinchi nashr), Filadelfiya: V.B. Saunders, 49-55 betlar, doi:10.1016 / b978-0-323-07446-9.00006-4, ISBN 978-0-323-07446-9, olingan 2020-11-16
- ^ Rutter, Jared (2013 yil 23-yanvar). "Mitokondriyal piruvat tashuvchisiga uzoq va burilishli yo'l". Saraton va metabolizm. doi:10.1186/2049-3002-1-6. PMID 24280073.
- ^ "Piruvat dehidrogenaza etishmovchiligi". Genetika bo'yicha ma'lumot. Olingan 17 mart, 2013.
Tashqi havolalar
- https://web.archive.org/web/20070405211049/http://www.dentistry.leeds.ac.uk/biochem/MBWeb/mb1/part2/krebs.htm#animat1 - PDC umumiy mexanizmining animatsiyasi (yuqori o'ngdagi havola) da Lids universiteti
- Piruvat + Dehidrogenaza + kompleksi AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
3D tuzilmalar
- Chjou, X.; Makkarti, B .; O'Konnor, M.; Rid, J .; Stoops, K. (2001 yil dekabr). "Eukaryotik piruvat dehidrogenaza komplekslarining ajoyib tarkibiy va funktsional tashkil etilishi". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 98 (26): 14802–14807. Bibcode:2001 yil PNAS ... 9814802Z. doi:10.1073 / pnas.011597698. ISSN 0027-8424. PMC 64939. PMID 11752427., sigir buyrak piruvat dehidrogenaza kompleksi
- Yu, X .; Xiromasa, Y .; Tsen, H.; Bekatlar, K .; Roche, E .; Chjou, H. (Yanvar 2008). "Inson piruvat dehidrogenaza kompleksi yadrolarining tuzilmalari: N-terminalli egiluvchan egalik qiluvchi yuqori konservalangan katalitik markaz". Tuzilishi. 16 (1): 104–114. doi:10.1016 / j.str.2007.10.024. ISSN 0969-2126. PMC 4807695. PMID 18184588., PDC ning insonning to'liq va qisqartirilgan E2 (tE2) yadrolari E. coli
ATP ADP ATP ADP + + 2 ×  2 ×  2 × 3-fosfogliserat 2 ×  2 × 2-fosfogliserat 2 ×  2 × Fosfoenolpiruvat 2 ×  ADP ATP 2 × Piruvat 2 × |





