ATP sitrat liaza - ATP citrate lyase
| Inson ATP sitrat liazasi | |||||||
|---|---|---|---|---|---|---|---|
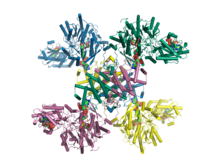 Sitrat, koenzim A va Mg.ADP bilan kompleksda inson ATP sitrat liazasining kristalli tuzilishi.[1] | |||||||
| Identifikatorlar | |||||||
| Belgilar | HAQIDA | ||||||
| Alt. belgilar | ACL | ||||||
| NCBI geni | 47 | ||||||
| HGNC | 115 | ||||||
| OMIM | 108728 | ||||||
| PDB | 3MWE, 3PFF, 5TDE, 5TDF, 5TDM, 5TDZ, 5TE1, 5TEQ, 5TES, 5TET, 6HXH, 6HXK, 6HXL, 6HXM, 6O0H, 6QFB 3MWD, 3MWE, 3PFF, 5TDE, 5TDF, 5TZ, 5TF, 5TDM, , 5TET, 6HXH, 6HXK, 6HXL, 6HXM, 6O0H, 6QFB | ||||||
| RefSeq | NM_001096 | ||||||
| UniProt | P53396 | ||||||
| Boshqa ma'lumotlar | |||||||
| EC raqami | 2.3.3.8 | ||||||
| Lokus | Chr. 17 q21.2 | ||||||
| |||||||
ATP sitrat liaz (ACLY) bu ferment bu hayvonlarda muhim qadamni anglatadi yog 'kislotasi biosintezi.[2] Konvertatsiya qilish orqali sitrat ga atsetil-KoA, fermentlar havolalari uglevod almashinuvi, u sitrat hosil qiladi oraliq, bilan yog 'kislotasi biosintezi, atsetil-KoA iste'mol qiladi.[3] O'simliklarda ATP sitrat liaza hosil qiladi sitosolik minglab ixtisoslashgan asetil-CoA kashshoflari metabolitlar, shu jumladan mumlar, sterollar va poliketidlar.[4]
Funktsiya
ATP sitrat liaza sintezi uchun javob beradigan asosiy ferment hisoblanadi sitosolik atsetil-KoA ko'plab to'qimalarda. Ferment a tetramer aftidan bir xil subbirliklarning. Hayvonlarda mahsulot, asetil-KoA, bir nechta muhim biosintez yo'llarida, shu jumladan ishlatiladi lipogenez va xolesterogenez.[5] U insulin bilan faollashadi.[6]
O'simliklarda ATP sitrat liazasi sitosol-sintez qilingan metabolitlar uchun atsetil-KoA hosil qiladi; Asetil-KoA o'simliklarning hujayra osti membranalari orqali tashilmaydi. Bunday metabolitlarga quyidagilar kiradi: cho'zilgan yog 'kislotalari (urug' yog'larida, membranada ishlatiladi) fosfolipidlar, keramid qismlar sfingolipidlar, kutikula, cutin va suberin ); flavonoidlar; malon kislotasi; atsetillangan fenolik, alkaloidlar, izoprenoidlar, antosiyaninlar va shakar; va mevalonatdan olingan izoprenoidlar (masalan, sesquiterpenes, sterollar, brassinosteroidlar ); malonil va asil-hosilalar (d-aminokislotalar, malonillangan flavonoidlar, asilatlangan, prenillangan va malonatlangan oqsillar).[4] O'simliklar tarkibidagi yog 'kislotasi biosintezi plastidlar; Shunday qilib, ATP sitrat liazasi ushbu yo'l uchun ahamiyatli emas.
Reaksiya
ATP sitrat liaza sitrat konversiyasini katalizatori uchun javobgardir Koenzim A (CoA) dan atsetil-KoA ga va oksaloatsetat, ning gidrolizidan kelib chiqadi ATP.[3] ATP va KoA ishtirokida sitrat liaza parchalanishini katalizlaydi sitrat atsetil CoA hosil qilish uchun, oksaloatsetat, adenozin difosfat (ADP) va ortofosfat (Pmen):
- sitrat + ATP + CoA → oksaloasetat + Asetil-KoA + ADP + Pmen
Ushbu ferment ilgari berilgan EC raqami 4.1.3.8.[7]
Manzil
Ferment sitosolik o'simliklarda [4] va hayvonlar.
Tuzilishi
Ferment tarkibidagi ikkita subbirlikdan iborat yashil o'simliklar (shu jumladan Xlorofitlar, Marchantimorpha, Bryopsida, Pinaceae, bir pallali va Eudicots ), turlari qo'ziqorinlar, glaukofitlar, Xlamidomonalar va prokaryotlar.
Hayvonlarning ACL fermentlari gomomerik; a birlashma ACLA va ACLB genlaridan, ehtimol, ushbu qirollikning evolyutsion tarixida paydo bo'lgan.[4]
Sutemizuvchilar ATP sitrat liazasi a ga ega N-terminal a ni qabul qiladigan sitrat bilan bog'laydigan domen Rossmann katlamasi, keyin CoA bog'laydigan domeni va CoA-ligaz domeni va nihoyat a C-terminali sitrat sintaz domeni. CoA biriktiruvchi va sitrat sintaz domenlari orasidagi yoriq hosil bo'ladi faol sayt ikkala sitrat va atsetil-koenzim A bog'langan ferment.
2010 yilda odamning kesilgan ATP sitrat liazasi tuzilishi aniqlandi Rentgen difraksiyasi 2.10 piksellar soniga Å.[3] 2019 yilda koenzim A, sitrat va Mg.ADP substratlari bilan kompleksda inson ACLY ning to'liq uzunlikdagi tuzilishi rentgen kristallografiyasi bilan 3,2 pikselgacha aniqlandi.[1] Bundan tashqari, 2019 yilda ACLY ning ingibitor bilan kompleksdagi to'liq uzunlikdagi tuzilishi kryo-EM usullari bilan 3.7 resolution piksellar soniga qadar aniqlandi.[8] Dan heteromerik ACLY-A / B qo'shimcha tuzilmalari yashil oltingugurt bakteriyalari Xlorobium limikola va arxeon Methanosaeta concilii ACLY arxitekturasi ekanligini ko'rsating evolyutsion ravishda saqlanib qolgan.[1] To'liq uzunlikdagi ACLY tuzilmalari shuni ko'rsatdiki, tetramerik oqsil o'zining C-terminal domeni orqali oligomerlanadi. Oldindan aniqlangan kesilgan kristalli tuzilmalarda C-terminal domeni kuzatilmagan. ACLY ning C-terminal mintaqasi strukturaviy jihatdan o'xshash bo'lgan tetramerik modulda yig'iladi sitril-KoA liazasi (CCL) chuqur dallanadigan bakteriyalarda uchraydi.[1][9] Ushbu CCL moduli sitril-KoA oraliq mahsulotining atsetil-KoA va oksaloatsetat mahsulotlariga bo'linishini katalizlaydi.
Farmakologiya
Fermentning ta'sirini koenzim A-konjugati tormozlashi mumkin bempedoik kislota, tushiradigan birikma LDL xolesterin odamlarda.[10] Preparat tomonidan tasdiqlangan Oziq-ovqat va dori-darmonlarni boshqarish 2020 yil fevral oyida Qo'shma Shtatlarda foydalanish uchun.
Adabiyotlar
- ^ a b v d Verschueren KH, Blanchet C, Feliks J, Danserkoer A, De Vos D, Bloch Y va boshq. (Aprel 2019). "ATP sitrat liazasining tuzilishi va Krebs siklida sitrat sintazning kelib chiqishi". Tabiat. 568 (7753): 571–575. Bibcode:2019 yil natur.568..571V. doi:10.1038 / s41586-019-1095-5. PMID 30944476. S2CID 92999924.
- ^ Elshourbagy NA, JC yaqinida, Kmetz PJ, Wells TN, Groot PH, Saxty BA va boshq. (1992 yil mart). "Odamning ATP-sitrat liazasi cDNA ning klonlanishi va ekspressioni". Evropa biokimyo jurnali. 204 (2): 491–9. doi:10.1111 / j.1432-1033.1992.tb16659.x. PMID 1371749.
- ^ a b v Sun T, Xayakava K, Beyteman KS, Freyzer ME (avgust 2010). "X-nurli kristallografiya yordamida odamning ATP-sitrat liazasining sitrat bilan bog'lanish joyini aniqlash". Biologik kimyo jurnali. 285 (35): 27418–28. doi:10.1074 / jbc.M109.078667. PMC 2930740. PMID 20558738.
- ^ a b v d Fatland BL, Ke J, Anderson MD, Mentzen WI, Cui LW, Allred CC va boshq. (2002 yil oktyabr). "Arabidopsisda sitosolik atsetil-koenzim A hosil qiluvchi heteromerik ATP-sitrat liazaning molekulyar tavsifi". O'simliklar fiziologiyasi. 130 (2): 740–56. doi:10.1104 / pp.008110. PMC 166603. PMID 12376641.
- ^ "Entrez Gen: ATP sitrat liaza".
- ^ Guay C, Madiraju SR, Aumais A, Joly E, Prentki M (dekabr 2007). "ATP-sitrat liaza, molik ferment va piruvat / sitrat tsiklining glyukozadan kelib chiqqan insulin sekretsiyasidagi roli". Biologik kimyo jurnali. 282 (49): 35657–65. doi:10.1074 / jbc.M707294200. PMID 17928289.
- ^ ATP + Sitrat + Lyaza AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
- ^ Vey J, Leyt S, Kuai J, Terrien E, Rafi S, Xarvud XJ va boshq. (Aprel 2019). "Odam ATP-sitrat liazasini kuchli inhibatsiyasi uchun allosterik mexanizm". Tabiat. 568 (7753): 566–570. Bibcode:2019Natur.568..566W. doi:10.1038 / s41586-019-1094-6. PMID 30944472. S2CID 93000843.
- ^ Aoshima M, Ishii M, Igarashi Y (may 2004). "Hydrogenobacter thermophilus TK-6 tarkibidagi sitrat parchalanish reaktsiyasining ikkinchi bosqichini katalizlovchi yangi ferment, sitril-KoA liaza". Molekulyar mikrobiologiya. 52 (3): 763–70. doi:10.1111 / j.1365-2958.2004.04010.x. PMID 15101982. S2CID 32105039.
- ^ Ray KK, Bays HE, Catapano AL, Lalwani ND, Bloedon LT, Sterling LR va boshq. (CLEAR Harmony Trial) (2019 yil mart). "LDL xolesterolini kamaytirish uchun bempedoik kislota xavfsizligi va samaradorligi". Nyu-England tibbiyot jurnali. 380 (11): 1022–1032. doi:10.1056 / NEJMoa1803917. PMID 30865796.
Qo'shimcha o'qish
- Lovell SC, Devis IW, Arendall WB, de Bakker PI, Word JM, Prisant MG va boshq. (2003 yil fevral). "Kalfa geometriyasi bo'yicha strukturani tasdiqlash: phi, psi va Cbeta deviatsiyasi". Oqsillar. 50 (3): 437–50. doi:10.1002 / prot.10286. PMID 12557186.
Tashqi havolalar
- ATP sitrat liazasi AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
Ushbu maqolada Amerika Qo'shma Shtatlarining Milliy tibbiyot kutubxonasi ichida joylashgan jamoat mulki.
