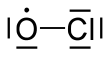Xlor monoksit - Chlorine monoxide - Wikipedia
Ushbu maqola umumiy ro'yxatini o'z ichiga oladi ma'lumotnomalar, lekin bu asosan tasdiqlanmagan bo'lib qolmoqda, chunki unga mos keladigan etishmayapti satrda keltirilgan. (Aprel 2020) (Ushbu shablon xabarini qanday va qachon olib tashlashni bilib oling) |
| |||
| Ismlar | |||
|---|---|---|---|
| IUPAC nomi afzal Xlor monoksit | |||
| Tizimli IUPAC nomi Xloroksidanil | |||
| Boshqa ismlar Xlor (II) oksidi | |||
| Identifikatorlar | |||
3D model (JSmol ) | |||
| Qisqartmalar | ClO (.) | ||
| ChEBI | |||
| ChemSpider | |||
| MeSH | Xlorosil | ||
PubChem CID | |||
| UNII | |||
CompTox boshqaruv paneli (EPA) | |||
| |||
| |||
| Xususiyatlari | |||
| ClO | |||
| Molyar massa | 51.45 g · mol−1 | ||
| Termokimyo | |||
Std entalpiyasi shakllanish (ΔfH⦵298) | 101,8 kJ / mol[1] | ||
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |||
| Infobox ma'lumotnomalari | |||
Xlor monoksit kimyoviy moddadir radikal kimyoviy formulasi bilan . Jarayonida muhim rol o'ynaydi ozon qatlami. In stratosfera, xlor atomlari bilan reaksiyaga kirishadi ozon xlor monoksit hosil qilish uchun molekulalar va kislorod.
Ushbu reaktsiya ozon qatlamining yemirilishiga olib keladi.[1] Bu natija radikallar quyidagi kabi reaksiyaga kirishishi mumkin:
xlor radikalini qayta tiklash. Shu tarzda, ozonning parchalanishi uchun umumiy reaktsiya xlor bilan katalizlanadi, chunki oxir-oqibat xlor o'zgarishsiz qoladi. Umumiy reaktsiya:
Bu foydalanishning muhim ta'siri bo'ldi CFClar stratosferaning yuqori qismida, ammo ko'plab mamlakatlar CFClardan foydalanishni taqiqlashga rozi bo'lishdi. CFC ning reaktiv bo'lmagan xususiyati ularni stratosferaga o'tishiga imkon beradi, u erda ular Cl-radikallarini hosil qilish uchun fotos-dissotsiatsiyaga uchraydi. Keyin ular tezda xlor oksidini hosil qiladi va bu tsikl ikkitagacha davom etishi mumkin radikallar shaklga reaktsiya diklor oksidi, radikal reaktsiyani tugatish. Atmosferadagi CFClarning kontsentratsiyasi juda past bo'lgani sababli, tugash reaktsiyasi ehtimoli juda past, ya'ni har bir radikal minglab ozon molekulalarini parchalashi mumkin.
Ko'pgina mamlakatlarda CFClardan foydalanish taqiqlangan bo'lsa ham, CFClar taxminan 50-500 yil davomida atmosferada qolishi mumkin. Bu ko'plab xlor radikallarini hosil bo'lishiga olib keladi va shuning uchun xlor radikallari xlor oksidi bilan reaksiyaga kirishishdan oldin ozon molekulalarining katta qismi parchalanadi. Diklor oksidi.
Adabiyotlar
- ^ a b Egon Wiberg; Nils Viberg; Arnold Frederik Xolman (2001). Anorganik kimyo. Akademik matbuot. p. 462. ISBN 0-12-352651-5.
| Bu noorganik birikma - tegishli maqola a naycha. Siz Vikipediyaga yordam berishingiz mumkin uni kengaytirish. |