HK1 - HK1
Geksokinaz-1 (HK1) - bu ferment odamlarda kodlanganligi HK1 gen 10-xromosomada. Geksokinazlar fosforilat glyukoza ishlab chiqarish glyukoza-6-fosfat (G6P), glyukoza metabolizmining ko'pgina yo'llarida birinchi qadam. Ushbu gen heksokinazning hamma joyda uchraydigan shaklini kodlaydi va u lokalizatsiya qilinadi mitoxondriyaning tashqi membranasi. Ushbu genning mutatsiyalari bilan bog'liq bo'lgan gemolitik anemiya geksokinaz etishmovchiligi tufayli. Muqobil biriktirish Ushbu genning natijalari turli xil kodlangan beshta transkript variantlariga olib keladi izoformlar, ularning ba'zilari to'qimalarga xosdir. Har bir izoformning o'ziga xos xususiyati bor N-terminali; oqsilning qolgan qismi barcha izoformalar orasida bir xildir. Oltinchi transkript varianti tavsiflangan, ammo ularning bir nechtasi borligi sababli kodonlarni to'xtatish, oqsilni kodlaydi deb o'ylamaydi. [RefSeq tomonidan taqdim etilgan, 2009 yil aprel][5]
Tuzilishi
HK1 - sutemizuvchi hujayralardagi to'rtta yuqori homolog heksokinaza izoformlaridan biri.[6][7]
Gen
The HK1 gen taxminan 131 ni tashkil qiladi kb va 25 dan iborat exons. Muqobil biriktirish uning 5 ’ekzonsidan har xil hujayra turlarida turli xil transkriptlar hosil bo'ladi: 1-5 va 8 ekzonlari (T1-6 ekzonlari) moyakka xos ekzonlar; moyakga xos ekzonlarning quyi qismida taxminan 15 kb joylashgan exon 6 bu eritroid -spesifik ekzon (exon R); va ekzon 7, R ekzonining quyi oqimida taxminan 2,85 kb, hamma joyda ifoda etilgan HK1 izoformasi uchun birinchi 5 ’ekzonidir. Bundan tashqari, exon 7 sutemizuvchilarda saqlanib qolgan porin bilan bog'lovchi domeni (PBD) kodlaydi HK1 genlar. Shu bilan birga, qolgan 17 ekszon barcha HK1 izoformalari o'rtasida taqsimlanadi.
Ekson R ga qo'shimcha ravishda, proksimalning cho'zilishi targ'ibotchi tarkibida GATA elementi, SP1 uchastkasi, CCAAT va Etsni bog'laydigan motifi eritroid hujayralarida HK-R ekspresiyasi uchun zarurdir.[6]
Oqsil
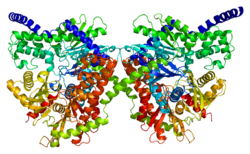
Ushbu gen 100 kDa ni kodlaydi homodimer tartibga soluvchi bilan N-terminal domen (1-475), katalitik C-terminali domen (qoldiqlar 476-917) va an alfa-spiral uning ikkita kichik birligini birlashtiradi.[6][8][9][10] Ikkala terminal domenlari ham katta subdomain va kichik subdomainlardan tashkil topgan. C-terminal katta subdomainning moslashuvchan hududi (qoldiqlar 766-810) turli lavozimlarni egallashi mumkin va ular bilan o'zaro aloqada bo'lish taklif etiladi tayanch ATP. Bundan tashqari, glyukoza va G6P N-va C-terminallar domenlarida yaqinlashib, C-terminallar domenining umumiy konformatsion holatini barqarorlashtiradi.[8][9] Bir modelga ko'ra, G6P an vazifasini bajaradi allosterik yopiq konformatsiyasini barqarorlashtirish uchun N-terminal domenini bog'laydigan inhibitor, keyinchalik ATP-ni bloklaydigan C-terminal egiluvchan subdomain konformatsiyasini barqarorlashtiradi. Ikkinchi model, G6P ning yopiq konformatsiyani barqarorlashtiradigan va C-terminalini bog'lash joyi uchun ATP bilan raqobatlashadigan faol inhibitor sifatida harakat qilishini anglatadi.[8] Bir nechta tadqiqotlar natijalari shuni ko'rsatadiki, C-terminal ham katalitik, ham tartibga soluvchi ta'sirga ega.[11] Shu bilan birga, hidrofobik N-terminalda o'z-o'zidan fermentativ faollik yo'q, ammo tarkibida G6P tartibga soluvchi joy va PBD mavjud bo'lib, u oqsilning barqarorligi va uning birikishi uchun javobgardir. tashqi mitoxondriyal membrana (OMM).[6][12][10][13]
Funktsiya
Geksokinazaning ikkita mitoxondriyal izoformasidan biri va shakar kinaz oilasiga mansub HK1 kataliz qiladi The stavkani cheklash va glyukoza metabolizmining birinchi majburiy bosqichi, bu glyukozaning ATP ga bog'liq bo'lgan fosforillanishi G6P ga.[8][7][10][14] G6P ning fiziologik darajasi ushbu jarayonni HK1 ni inhibe qilish orqali tartibga solishi mumkin salbiy teskari aloqa, Garchi noorganik fosfat (Pmen) G6P inhibisyonunu engillashtirishi mumkin.[8][12][10] Biroq, farqli o'laroq HK2 va HK3, HK1 ning o'zi to'g'ridan-to'g'ri P tomonidan tartibga solinmaganmen, bu hamma joyda yaxshi mos keladi katabolik rol.[7] Glyukozani fosforlash orqali HK1 glyukozani hujayradan chiqib ketishini samarali ravishda oldini oladi va shu bilan energiya almashinuviga glyukoza kiradi.[8][13][12][10] Bundan tashqari, uning lokalizatsiyasi va OMMga birikishi glikolizning mitoxondriyal bilan birikishiga yordam beradi. oksidlovchi fosforillanish, bu hujayraning energiya talablarini qondirish uchun mitoxondriyal ATP / ADPni to'g'ridan-to'g'ri qayta ishlash orqali ATP ishlab chiqarishni sezilarli darajada yaxshilaydi.[14][10][15] Xususan, OMM bilan bog'langan HK1 bog'lanadi VDAC1 ochilishini boshlash uchun mitokondriyal o'tkazuvchanlik o'tish gözenek va glyukolitik jarayonni yanada kuchaytirish uchun mitoxondriyal ATPni chiqaring.[10][7]
OMM bilan bog'langan HK1 uchun yana bir muhim funktsiya hujayralarning omon qolishi va himoya qilishdir oksidlovchi zarar.[14][7] Faollashtirish Akt kinaz o'sish faktori vositasida bo'lgan fosfatidil inositol 3-kinaz (PI3) / Akt hujayralarining omon qolishining hujayra ichidagi signal yo'lining bir qismi sifatida HK1-VDAC1 birikmasi vositachiligida bo'ladi sitoxrom v ozod qilish va keyingi apoptoz.[14][6][10][7] Aslida, VDAC anti-apoptotik HK1 va pro-apoptotik bilan bog'lanishiga oid dalillar mavjud kreatin kinaz o'zaro eksklyuziv bo'lib, HK1 yo'qligi kreatin kinazning VDACni bog'lashiga va ochilishiga imkon beradi.[7] Bundan tashqari, HK1 piyodalarga qarshiapoptotik antagonizatsiya qilish orqali faoliyat Bcl-2 keyinchalik inhibe qiladigan OMMda joylashgan oqsillar TNF - apoptoz.[6][13]
In prefrontal korteks, HK1 taxminiy ravishda protein kompleksini hosil qiladi EAAT2, Na + / K + ATPaza va akonitaza, qaysi funktsiyalarni olib tashlash kerak glutamat perisinaptik bo'shliqdan kelib chiqadi va sinaptik yoriq.[15]
Xususan, HK1 to'rtta geksokinaza orasida eng ko'p ifoda etilgan izoformdir va asosan ko'p to'qimalarda konstruktiv tarzda namoyon bo'ladi. miya, buyrak va qizil qon hujayralari (RBC).[6][8][13][7][15][10][16] Uning yuqori mo'lligi retina, xususan, fotoreseptor ichki segmenti, tashqi pleksiform qatlam, ichki yadro qatlami, ichki pleksiform qatlam va ganglion hujayralari qatlami uning muhim metabolik maqsadini tasdiqlaydi.[17] Bundan tashqari, olingan hujayralarda ham ifodalanadi gemopoetik ildiz hujayralari masalan, RBClar, leykotsitlar va trombotsitlar, shuningdek, eritroid-progenitor hujayralardan.[6] Shuni ta'kidlash kerakki, HK1 hujayralar va to'qimalarda mavjud bo'lgan yagona heksokinaz izoformidir, ular glyukoza metabolizmiga, shu jumladan miya, eritrotsitlar, trombotsitlar, leykotsitlar va boshqa funktsiyalar uchun ko'proq bog'liqdir. fibroblastlar.[18] Sichqonlarda, shuningdek, homila to'qimalarida heksokinaza ustunlik qiladi, ehtimol bu ularning tarkibiy glyukoza ishlatilishi bilan bog'liq.[12][16]
Klinik ahamiyati
Mutatsiyalar ushbu genda 4H ning turi bilan bog'liq Charcot-Mari-Tish kasalligi, shuningdek, Russe tipidagi irsiy vosita va sezgir neyropatiya (HMSNR) deb nomlanadi.[19] Glikolizdagi HK1ning hal qiluvchi roli tufayli geksokinaz etishmovchiligi eritroenzimopatiyalarning sababi sifatida aniqlandi irsiy sperotsitik bo'lmagan gemolitik anemiya (HNSHA). Xuddi shu tarzda, HK1 etishmovchiligi olib keldi miya oq materiya shikastlanish, malformatsiyalar va psixomotor sustkashlik, shuningdek yashirin qandli diabet va panmiyelopatiya.[6] Ayni paytda, HK1 yuqori darajada ifoda etilgan saraton, va uning anti-apoptotik ta'siri yuqori glikolitikada kuzatilgan gepatoma hujayralar.[13][6]
Neyrodejenerativ kasalliklar
HK1 ga sababiy bog'liq bo'lishi mumkin kayfiyat va psixotik kasalliklar, shu jumladan bir kutupli tushkunlik (UPD), bipolyar buzilish (BPD) va shizofreniya uning energiya almashinuvidagi va hujayralarning omon qolishidagi ikkala roli orqali. Masalan, BPD va SCHZ bemorlarining miyasida laktat to'planishi potentsial ravishda HK1 ning OMM dan ajralishi va kengayish natijasida mitoxondriyal oksidlanishdan glikoliz, fosforillanish natijasida yuzaga keladi. SCHZ holatida HK1 ning OMM ga qo'shilishini kamaytiradi parietal korteks natijada glutamatni qaytarib olish qobiliyati pasayadi va shu sababli glutamat qaytib kelib chiqadi sinapslar. Chiqarilgan glutamat ekstrinaptik glutamat retseptorlarini faollashtiradi, bu esa glutamat zanjirlarining tuzilishi va ishlashining o'zgarishiga olib keladi, sinaptik plastika, frontal kortikal disfunktsiya va oxir-oqibat, SCHZga xos bo'lgan bilim etishmovchiligi.[15] Xuddi shunday, Hk1 mitoxondriyal ajralishi ham bog'liq bo'lgan hipotiroidizm, bu miyaning anormal rivojlanishi va xavfini oshirishni o'z ichiga oladi depressiya, uning biriktirilishi esa asabiy o'sish.[14] Yilda Parkinson kasalligi, Orqali VDAC dan HK1 ajralib chiqishi Parkin - vositachilik hamma joyda o'xshashlik va degradatsiya MPTP-ni buzadi depolarizatsiyalangan mitoxondriya, natijada Parkinning mitoxondriyal lokalizatsiyasini blokirovka qiladi va glikolizni to'xtatadi.[7] Turli xil psixiatrik kasalliklar uchun turli xil hujayralar turlarida zarur bo'lgan nisbiy HK1 dekolmanini aniqlash uchun qo'shimcha tadqiqotlar talab etiladi. Ushbu tadqiqot, shuningdek, gen mutatsiyasidan tortib, omillar ta'siriga aralashishga qadar ajralishning maqsadli sabablarini davolashni rivojlantirishga hissa qo'shishi mumkin. beta-amiloid peptid va insulin.[14]
Retinit pigmentozasi
A heterozigot missensiya mutatsiyasi ichida HK1 geni (847 holatidagi glutamatdan lizinga o'zgarishi) bilan bog'langan retinit pigmentozasi.[20][17] Shu vaqtdan beri almashtirish mutatsiyasi ma'lum funktsional joylardan uzoqda joylashgan va fermentning glikolitik faolligini buzmaydi, ehtimol mutatsiya retinaga xos bo'lgan boshqa biologik mexanizm orqali harakat qiladi.[20] Sichqoncha retinasida olib borilgan tadqiqotlar Hk1, mitoxondriyal metallochaperon Cox11 va shaperon oqsili Ranbp2 o'rtasidagi o'zaro ta'sirni aniqlaydi, bu esa retinada normal metabolizm va funktsiyalarni saqlab turishga xizmat qiladi. Shunday qilib, mutatsiya bu o'zaro ta'sirlarni buzishi va retinaning degradatsiyasiga olib kelishi mumkin.[17] Shu bilan bir qatorda, bu mutatsiya fermentning anti-apoptotik funktsiyasi orqali harakat qilishi mumkin, chunki insulin retseptorlari tomonidan heksokinaz-mitoxondriya assotsiatsiyasining regulyatsiyasini buzish fotoreseptor apoptozini va retinaning degeneratsiyasini keltirib chiqarishi mumkin.[20][17] Bunday holda, geksokinaz-mitoxondriya assotsiatsiyasini saqlaydigan muolajalar potentsial terapevtik yondashuv bo'lib xizmat qilishi mumkin.[17]
O'zaro aloqalar
HK1 ma'lum o'zaro ta'sir qilish bilan:
Interaktiv yo'l xaritasi
Tegishli maqolalarga havola qilish uchun quyidagi genlar, oqsillar va metabolitlarni bosing.[§ 1]
- ^ Interfaol yo'l xaritasini WikiPathways-da tahrirlash mumkin: "Glikoliz Glyukoneogenez_WP534".
Shuningdek qarang
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000156515 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000037012 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Entrez Gen: HK1 geksokinaz 1".
- ^ a b v d e f g h men j Murakami K, Kanno H, Tancabelic J, Fujii H (2002). "Eritroid hujayralarida geksokinazning gen ekspressioni va biologik ahamiyati". Acta Haematologica. 108 (4): 204–9. doi:10.1159/000065656. PMID 12432216. S2CID 23521290.
- ^ a b v d e f g h men j k Okatsu K, Iemura S, Koyano F, Go E, Kimura M, Natsume T, Tanaka K, Matsuda N (noyabr 2012). "Mitokondriyal geksokinaz HKI - bu Parkin ubikuitin ligazasining yangi substratidir". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 428 (1): 197–202. doi:10.1016 / j.bbrc.2012.10.041. PMID 23068103.
- ^ a b v d e f g Aleshin AE, Zeng C, Bourenkov GP, Bartunik HD, Fromm HJ, Honzatko RB (Yanvar 1998). "Geksokinazani boshqarish mexanizmi: inson miyasida rekombinant geksokinazaning kristal tuzilishidan glyukoza va glyukoza-6-fosfat bilan komplekslangan yangi tushunchalar". Tuzilishi. 6 (1): 39–50. doi:10.1016 / s0969-2126 (98) 00006-9. PMID 9493266.
- ^ a b Aleshin AE, Kirby C, Liu X, Bourenkov GP, Bartunik HD, Fromm HJ, Honzatko RB (2000 yil mart). "Mutant monomerik geksokinaza I ning kristalli tuzilmalari ko'p miqdordagi ADP bog'lanish joylarini va allosterik regulyatsiyaga tegishli konformatsion o'zgarishlarni ochib beradi". Molekulyar biologiya jurnali. 296 (4): 1001–15. doi:10.1006 / jmbi.1999.3494. PMID 10686099.
- ^ a b v d e f g h men Robey RB, Xey N (2006 yil avgust). "Mitokondriyal geksokinazalar, o'sish omillarining antapoptotik ta'sirining yangi vositachilari va Akt". Onkogen. 25 (34): 4683–96. doi:10.1038 / sj.onc.1209595. PMID 16892082.
- ^ Kardenas, ML; Cornish-Bowden, A; Ureta, T (1998 yil 5 mart). "Geksokinazlarning evolyutsiyasi va regulyativ roli". Biochimica et Biofhysica Acta (BBA) - Molekulyar hujayralarni tadqiq qilish. 1401 (3): 242–64. doi:10.1016 / s0167-4889 (97) 00150-x. PMID 9540816.
- ^ a b v d Printz RL, Osawa H, Ardehali H, Koch S, Granner DK (Fevral 1997). "Geksokinaz II geni: tuzilishi, regulyatsiyasi va targ'ibotchini tashkil qilish". Biokimyoviy jamiyat bilan operatsiyalar. 25 (1): 107–12. doi:10.1042 / bst0250107. PMID 9056853.
- ^ a b v d e Schindler A, Foley E (2013 yil dekabr). "Geksokinaz 1 mitoxondriyadagi apoptotik signallarni bloklaydi". Uyali signalizatsiya. 25 (12): 2685–92. doi:10.1016 / j.cellsig.2013.08.035. PMID 24018046.
- ^ a b v d e f Regenold WT, Pratt M, Nekkalapu S, Shapiro PS, Kristian T, Fiskum G (yanvar 2012). "Geksokinaza 1 ning kayfiyat va psixotik buzilishlarda mitoxondriyal ajralishi: miya energiya almashinuvi va neyrotrofik signalizatsiya uchun ta'siri". Psixiatriya tadqiqotlari jurnali. 46 (1): 95–104. doi:10.1016 / j.jpsychires.2011.09.018. PMID 22018957.
- ^ a b v d e f g Shan D, D tog'i, Mur S, Haroutunian V, Meador-Vudruff JH, Makkullumsmit RE (2014 yil aprel). "Geksokinaz 1 ning g'ayritabiiy bo'linishi shizofreniyada glutamat transport oqsillari majmuasi buzilishini anglatadi". Shizofreniya tadqiqotlari. 154 (1–3): 1–13. doi:10.1016 / j.schres.2014.01.028. PMC 4151500. PMID 24560881.
- ^ a b Reid, S; Magistrlar, C (1985). "Geksokinazning rivojlanish xususiyatlari va to'qimalarning o'zaro ta'siri to'g'risida". Qarish va rivojlanish mexanizmlari. 31 (2): 197–212. doi:10.1016 / s0047-6374 (85) 80030-0. PMID 4058069. S2CID 40877603.
- ^ a b v d e Vang F, Vang Y, Chjan B, Chjao L, Lyubasyuk V, Vang K, Xu M, Li Y, Vu F, Ven S, Bernshteyn PS, Lin D, Chju S, Vang X, Chjan K, Chen R (Noyabr 2014) ). "HK1dagi mutansif mutatsiya pigmentozaning autosomal dominant retinitiga olib keladi". Tergovchi oftalmologiya va vizual fan. 55 (11): 7159–64. doi:10.1167 / iovs.14-15520. PMC 4224578. PMID 25316723.
- ^ Gjesing AP, Nilsen AA, Brandslund I, Kristensen S, Sandbek A, Yorgensen T, Vitte D, Bonnefond A, Froguel P, Xansen T, Pedersen O (25 iyul 2011). "HK1dagi genetik variantni miqdoriy metabolik xususiyatlarga va 2-toifa diabet tarqalishiga nisbatan o'rganish". BMC Tibbiy Genetika. 12: 99. doi:10.1186/1471-2350-12-99. PMC 3161933. PMID 21781351.
- ^ Insonda Onlayn Mendelian merosi (OMIM): 605285
- ^ a b v Sallivan LS, Koboldt DC, Boun SJ, Lang S, Blanton SH, Cadena E, Avery CE, Lyuis RA, Webb-Jones K, Wheaton DH, Birch DG, Coussa R, Ren H, Lopez I, Chakarova C, Koenekoop RK, Garsiya KA, Fulton RS, Uilson RK, Weinstock GM, Daiger SP (noyabr 2014). "Geksokinaza 1 (HK1) dominant mutatsiyasi retinit pigmentozasini keltirib chiqaradi". Tergovchi oftalmologiya va vizual fan. 55 (11): 7147–58. doi:10.1167 / iovs.14-15419. PMC 4224580. PMID 25190649.
Qo'shimcha o'qish
- Daniele A, Altruda F, Ferrone M, Silengo L, Romeo G, Archidiacono N, Rocchi M (1992). "Inson geksokinazi 1 genini 10q11 ---- qter ga xaritalash". Inson irsiyati. 42 (2): 107–10. doi:10.1159/000154049. PMID 1572668.
- Magnani M, Bianchi M, Kasabianka A, Stokki V, Daniele A, Altruda F, Ferrone M, Silengo L (Iyul 1992). "Rekombinant odam" mini'-geksokinaza "katalitik jihatdan faol va geksoz 6-fosfatlar bilan boshqariladi". Biokimyoviy jurnal. 285 (1): 193–9. doi:10.1042 / bj2850193. PMC 1132765. PMID 1637300.
- Magnani M, Serafini G, Byanki M, Kasabianka A, Stokki V (yanvar 1991). "Insonning geksokinaz I turi mikrogeterogenligi turli xil amino-terminal sekanslariga bog'liq". Biologik kimyo jurnali. 266 (1): 502–5. PMID 1985912.
- Adams V, Griffin LD, Gelb BD, Makkabe ER (iyun 1991). "Sichqon miyasi geksokinazasining oqsilli kinaz faolligi". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 177 (3): 1101–6. doi:10.1016 / 0006-291X (91) 90652-N. PMID 2059200.
- Murakami K, Blei F, Tilton V, Seaman C, Piomelli S (1990 yil fevral). "Geksokinazning odamning qizil qon tanachasiga xos izozimi (HKR)". Qon. 75 (3): 770–5. doi:10.1182 / qon.V75.3.770.770. PMID 2297576.
- Nishi S, Seino S, Bell GI (dekabr 1988). "Inson geksokinazasi: amino- va karboksil-terminal yarmlari ketma-ketligi gomologik". Biokimyoviy va biofizik tadqiqotlar bo'yicha aloqa. 157 (3): 937–43. doi:10.1016 / S0006-291X (88) 80964-1. PMID 3207429.
- Rijksen G, Akkerman JW, van den Wall Bake AW, Hofstede DP, Staal GE (Yanvar 1983). "Nonsferotsitli gemolitik anemiya bilan kasallangan bemorning qon hujayralarida umumiy heksokinaza etishmovchiligi". Qon. 61 (1): 12–8. doi:10.1182 / qon.V61.1.12.12. PMID 6848140.
- Byanki M, Magnani M (1995). "Neferositik gemolitik anemiya hosil qiluvchi geksokinaz mutatsiyalari". Qon hujayralari, molekulalar va kasalliklar. 21 (1): 2–8. doi:10.1006 / bcmd.1995.0002. PMID 7655856.
- Blachly-Dyson E, Zambronicz EB, Yu WH, Adams V, McCabe ER, Adelman J, Colombini M, Forte M (Yanvar 1993). "Tashqi mitoxondriyal membrana kanalining, odamning ikkita izoformasining xamirturushdagi klonlash va funktsional ifodasi, kuchlanishga bog'liq anion kanali". Biologik kimyo jurnali. 268 (3): 1835–41. PMID 8420959.
- Aleshin AE, Zeng C, Fromm HJ, Honzatko RB (1996 yil avgust). "Kristallanish va odam miyasi geksokinazasining dastlabki rentgenologik tahlili". FEBS xatlari. 391 (1–2): 9–10. doi:10.1016/0014-5793(96)00688-6. PMID 8706938. S2CID 44367910.
- Viskonti PE, Olds-Klark P, Moss SB, Kalab P, Travis AJ, de las Heras M, Kopf GS (Yanvar 1996). "Sichqoncha spermasida geksokinazning tirozin fosforillangan shaklining xususiyatlari va lokalizatsiyasi". Molekulyar ko'payish va rivojlanish. 43 (1): 82–93. doi:10.1002 / (SICI) 1098-2795 (199601) 43: 1 <82 :: AID-MRD11> 3.0.CO; 2-6. PMID 8720117.
- Mori C, Nakamura N, Welch JE, Shiota K, Eddy EM (may 1996). "Porin bilan bog'laydigan domenga ega bo'lmagan noyob 1-turdagi geksokinaza uchun mRNAlarning testisga xos ifodasi". Molekulyar ko'payish va rivojlanish. 44 (1): 14–22. doi:10.1002 / (SICI) 1098-2795 (199605) 44: 1 <14 :: AID-MRD2> 3.0.CO; 2-V. PMID 8722688.
- Murakami K, Piomelli S (1997 yil fevral). "Odamning qizil qon hujayralariga xos geksokinaza izozimasi uchun cDNA ni aniqlash". Qon. 89 (3): 762–6. doi:10.1182 / qon.V89.3.762. PMID 9028305.
- Ruzzo A, Andreoni F, Magnani M (Yanvar 1998). "Eritroidga xos ekzon odamning geksokinaz genida mavjud". Qon. 91 (1): 363–4. doi:10.1182 / qon.V91.1.363. PMID 9414310.
- Travis AJ, Foster JA, Rozenbaum NA, Viskonti PE, Gerton GL, Kopf GS, Moss SB (1998 yil fevral). "Mitokondriyaga, shuningdek, murin spermatozoidining boshiga va tolali qobig'iga porin bilan bog'lanish domeniga ega bo'lmagan jinsiy hujayralarga xos bo'lgan 1-turdagi geksokinazni nishonga olish". Hujayraning molekulyar biologiyasi. 9 (2): 263–76. doi:10.1091 / mbc.9.2.263. PMC 25249. PMID 9450953.
- Aleshin AE, Zeng C, Bourenkov GP, Bartunik HD, Fromm HJ, Honzatko RB (Yanvar 1998). "Geksokinazani boshqarish mexanizmi: inson miyasida rekombinant geksokinazaning kristal tuzilishidan glyukoza va glyukoza-6-fosfat bilan komplekslangan yangi tushunchalar". Tuzilishi. 6 (1): 39–50. doi:10.1016 / S0969-2126 (98) 00006-9. PMID 9493266.
- Ruzzo A, Andreoni F, Magnani M (1998 yil aprel). "Insonning geksokinaz I turi genining tuzilishi va 5 'yonbosh mintaqaning nukleotidlar ketma-ketligi". Biokimyoviy jurnal. 331 (2): 607–13. doi:10.1042 / bj3310607. PMC 1219395. PMID 9531504.
- Aleshin AE, Zeng C, Bartunik HD, Fromm HJ, Honzatko RB (sentyabr 1998). "Geksokinaz I ning regulyatsiyasi: glyukoza va fosfat bilan komplekslangan rekombinant inson miyasi geksokinazasining kristalli tuzilishi". Molekulyar biologiya jurnali. 282 (2): 345–57. doi:10.1006 / jmbi.1998.2017. PMID 9735292.
- Murakami K, Kanno H, Miwa S, Piomelli S (iyun 1999). "Inson HKR izozimi: geksokinaz I genini tashkil etish, eritroidga xos promotor va transkripsiyani boshlash joyi". Molekulyar genetika va metabolizm. 67 (2): 118–30. doi:10.1006 / mgme.1999.2842. PMID 10356311.