Kaliy geptafluorotantalat - Potassium heptafluorotantalate
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Dipotiyal heptafluorotantalat | |
| Tizimli IUPAC nomi Dipotiy heptafluorotantalum (2-) | |
| Boshqa ismlar Kaliy geptafluorotantalat (V) Kaliy florotantalat | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.037.245 |
| EC raqami |
|
PubChem CID | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
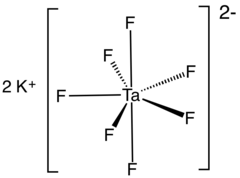
| K2[TaF7] | |
| Molyar massa | 392,13 g / mol |
| Tashqi ko'rinish | oq qattiq |
| Zichlik | 25 ° C da 4,56 g / ml |
| Erish nuqtasi | 630 dan 820 ° C gacha (1,166 dan 1508 ° F; 903 dan 1093 K gacha) |
| 0,5 g / 100 ml (15 ° C)[1] | |
| Xavf | |
| GHS piktogrammalari |   |
| GHS signal so'zi | Xavfli |
| H301, H315, H319, H331, H335 | |
| P261, P264, P270, P271, P280, P301 + 310, P302 + 352, P304 + 340, P305 + 351 + 338, P311, P312, P321, P330, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| O'lim dozasi yoki konsentratsiyasi (LD, LC): | |
LD50 (o'rtacha doz ) | 110 mg / kg (Og'iz: kalamush) |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Kaliy geptafluorotantalat bu noorganik birikma formulasi bilan K2[TaF7]. Bu heptafluorotantalatning kaliy tuzi anion [TaF7]2−. Bu oq, suvda eruvchan qattiq moddalar tozalashda oraliq vositadir tantal undan rudalar va metallning kashshofi hisoblanadi.[2]
Tayyorgarlik
Sanoat
Kaliy geptafluorotantalat metall tantalni sanoat ishlab chiqarishida oraliq mahsulot hisoblanadi. Uning ishlab chiqarilishi o'z ichiga oladi eritma kabi tantal rudalari kolumbit va tantalit, bilan gidroflorik kislota va sulfat kislota suvda eruvchan vodorod pentafluorotantalat ishlab chiqarish uchun.[2]
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
Ushbu yechim bir qatorga bo'ysunadi suyuqlik-suyuqlik ekstrakti metall aralashmalarini tozalash uchun qadamlar (eng muhimi niobiy ) davolashdan oldin ftorli kaliy ishlab chiqarish uchun K2[TaF7]
Laboratoriya ko'lami
Gidroflorik kislota ham korroziv, ham zaharli bo'lib, u bilan ishlash yoqimsiz; kichik hajmdagi sintezlar uchun bir qator muqobil jarayonlar ishlab chiqilgan. Kaliy heptafluorotantalat ikkalasi tomonidan ishlab chiqarilishi mumkin suvsiz va nam usullar. Suvsiz usul tantal oksidi bilan reaktsiyasini o'z ichiga oladi kaliy biflorid yoki ammoniy biflorid quyidagi tenglama bo'yicha:[1][3]
- Ta2O5 + 4 KHF2 + 6 HF → 2 K2[TaF7] + 5 H2O
Ushbu usul dastlab tomonidan xabar qilingan Berzeliy.[4]
K2[TaF7] ni, shuningdek, HF kontsentratsiyasi taxminan 42% dan past bo'lishi sharti bilan gidroflorik kislotadagi eritmalardan cho'ktirish mumkin. Yuqori HF konsentratsiyali eritmalar kaltsiy geksaflorotantalat beradi [KTaF6]. K-tuzni eritmasidan ham cho'ktirish mumkin gidroflorik kislota ning tantal pentaxlorid:
- 5 HF + 2 KF + TaCl5 → K2[TaF7] + 5 HCl
Tuzilishi
Kaliy heptafluorotantalat kamida ikkitasida mavjud polimorflar. a-K2[TaF7] ning eng keng tarqalgan shakli va kristallari monoklinik P21/ c kosmik guruh.[5] Tuzilishi [TaF7]2− kaliy ionlari bilan o'zaro bog'langan birliklar. [TaF7]2− polyhedra monokapped deb ta'riflanishi mumkin trigonal prizmalar to'rtburchaklar yuzlardan birida joylashgan yopiq atom bilan. Kaliy atomlari 9 koordinatali va buzilgan monokapped deb qaralishi mumkin kvadrat prizmalar.
230 ° C dan yuqori haroratlarda u D-K ga aylanadi2[TaF7], ya'ni ortorombik (kosmik guruh: Pnma). Ushbu tuzilish kaliy ionlari va murakkab anion [TaF7]2−. 7-koordinataning tuzilishi [TaF7]2− birliklar asosan o'zgarmaydi. Ammo kaliy atomlari hozirda 11 ta yoki 8 ta ftor atomlari bilan muvofiqlashtirilgan 2 ta muhitda mavjud.[6][7]
Reaksiyalar
K2[TaF7] asosan metall tantalini ishlab chiqarish uchun ishlatiladi kamaytirish bilan natriy. Bu taxminan 800 ° C da sodir bo'ladi eritilgan tuz va bir qator potentsial yo'llar orqali daromad oladi.[8]
K2[TaF7] gidrolizga moyil. Masalan, K ning qaynab turgan suvli eritmasi2[TaF7] kaliy oksiflorotantalat beradi (K2Ta2O3F6), "nomi bilan tanilganMarignac's tuz ”. Gidroliz va kaliy oksiflorotantalatning birgalikda cho'kishini oldini olish uchun eritmaga ozgina ortiqcha HF qo'shiladi.
Adabiyotlar
- ^ a b Preparat noorganik kimyo bo'yicha qo'llanma, 2-nashr. G. Brauer tomonidan tahrirlangan, Academic Press, 1963, NY. Vol. 1. p. 256.
- ^ a b Entoni Agulyanski (2004). "Tantal va niobiyni qayta ishlashda ftor kimyosi". Anatoliy Agulyanskida (tahrir). Tantal va niyobiy ftorli birikmalar kimyosi (1-nashr). Burlington: Elsevier. ISBN 9780080529028.
- ^ Agulyanskiy, A. "Qattiq, erigan va eritilgan sharoitda ftorotantalat kaliy" J. Ftor kimyosi 2003, 155-161. doi:10.1016 / S0022-1139 (03) 00190-8
- ^ J. J. Berzelius Pogg. Ann. 4, 6 (1825 #.)
- ^ Torardi, KC; Brixner, L.H .; Blasse, G. (1987). "K ning tuzilishi va lyuminesansi2TaF7 va K2NbF7". Qattiq jismlar kimyosi jurnali. 67 (1): 21–25. doi:10.1016/0022-4596#87)90333-1.
- ^ Langer, V. Smrčok, L. Boča, M. "Dipotasyum heptafluorotantalat # V #, b-K2TaF7, 509K da "Acta Crystallographica Bo'lim E 2006, E62, i91-i93. doi:10.1107 / S1600536806009147
- ^ Smrčok, Dubomir; Brunelli, Mishel; Boča, Miroslav; Kucharik, Marian (2008 yil 8 aprel). "K ning tuzilishi2TaF7 993 K da: sinxrotron kukunlari ma'lumotlari va qattiq holatdagi DFT hisob-kitoblaridan birgalikda foydalanish ". Amaliy kristalografiya jurnali. 41 (3): 634–636. doi:10.1107 / S0021889808005876.
- ^ Okabe, Toru X.; Sadoway, Donald R. (1998). "Metallotermik reduksiya elektron vositachilik reaktsiyasi sifatida". Materiallar tadqiqotlari jurnali. 13 (12): 3372–3377. Bibcode:1998JMatR..13.3372O. doi:10.1557 / JMR.1998.0459.
