Clostridium difficile toksini B - Clostridium difficile toxin B
| Toksin B | |||||||
|---|---|---|---|---|---|---|---|
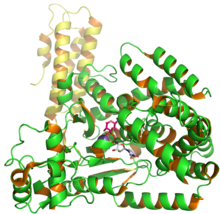 PDB kirishidan 2BVM dan UDP va gluzozani ko'rsatadigan C. difficile glyukosil transferaza Toksin B ning tuzilishi.[1] | |||||||
| Identifikatorlar | |||||||
| Organizm | |||||||
| Belgilar | toxB | ||||||
| Alt. belgilar | tcdB | ||||||
| Entrez | 4914074 | ||||||
| PDB | 2BVM | ||||||
| RefSeq (Prot) | YP_001087135.1 | ||||||
| UniProt | P18177 | ||||||
| Boshqa ma'lumotlar | |||||||
| EC raqami | 2.4.1.- | ||||||
| Xromosoma | genom: 0,79 - 0,8 Mb | ||||||
| |||||||
| TcdB toksini N-terminalli spiral domen | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| Belgilar | TcdB_N | ||||||||
| Pfam | PF12918 | ||||||||
| |||||||||
| TcdA / TcdB katalitik glikosiltransferaza domeni | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| Belgilar | TcdA_TcdB | ||||||||
| Pfam | PF12919 | ||||||||
| |||||||||
| Peptidaz C80 oilasi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| Belgilar | Peptidaza_C80 | ||||||||
| Pfam | PF11713 | ||||||||
| InterPro | IPR020974 | ||||||||
| |||||||||
| TcdA / TcdB teshiklarni hosil qilish domeni | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorlar | |||||||||
| Belgilar | TcdA_TcdB_pore | ||||||||
| Pfam | PF12920 | ||||||||
| TCDB | 1. C.57 | ||||||||
| OPM superfamily | 199 | ||||||||
| OPM oqsili | 6oq6 | ||||||||
| |||||||||
Clostridium difficile toksini B a sitotoksin bakteriyalar tomonidan ishlab chiqarilgan Clostridium difficile. Bu ikkita asosiy turdan biridir toksinlar tomonidan ishlab chiqarilgan C. difficile , ikkinchisi an enterotoksin (Toksin A ). Ikkalasi ham juda kuchli va o'limga olib keladi.[2][3]
Tuzilishi
Toksin B (TcdB) a sitotoksin molekulyar og'irligi 270 ga teng kDa va an izoelektrik nuqta, pl, 4.1 dan.[4] Toksin B to'rt xil tuzilish sohasiga ega: katalitik, sistein proteaz, translokatsiya va retseptorlarni bog'lash.[5] The N-terminal glyukoziltransferaza katalitik domen tarkibiga aminokislota qoldiqlari kiradi, 1-544 sistein proteaz domen 545-801 qoldiqlarini o'z ichiga oladi. Bundan tashqari, translokatsion mintaqada aminokislota qoldiqlari 802 dan 1664 gacha, retseptorlarni bog'lash hududi esa C-terminali 1665 dan 2366 gacha bo'lgan aminokislota qoldiqlarini o'z ichiga oladi.[5]
The glikosilatsiya B toksinining faolligi N-terminal katalitik mintaqa (qoldiqlar 1-544). Ushbu mintaqa har qanday sitotoksik faollikdan mustaqil ravishda glikosilatlar substratlarini hosil qiladi.[6] Shu bilan birga, retseptorlarni bog'lash hududining ozgina o'chirilishi B toksinlari faolligining susayishiga olib keladi.[6] Translokatsion mintaqada gidrofobik poyaga o'xshash tuzilma mavjud bo'lib, ular 958–1130 qoldiqlariga membranani yoyishda yordam beradi. teshiklar.[5] Tarkibiga kiradigan retseptorlarni bog'lash mintaqasi C-terminali takrorlanadigan mintaqa (CRR) TcdB membranasining o'zaro ta'sirini oshiradi, ammo teshik hosil bo'lishida ishtirok etmaydi.[7] Bunga qo'chimcha, sistein proteaz va translokatsion mintaqalar ikkalasi ham translokatsiya va retseptorlarni bog'lashda muhim funktsional rol o'ynaydigan murakkab tuzilmalarga ega.[8] Biroq, ning translokatsiya mintaqasini o'chirish aminokislotalar kamaytiradi sitotoksik faoliyat 4 marta. Ikkalasi ham sistein proteazlari va translokatsiya mintaqalarining aksariyati bandargohdir hidrofob TcdB va boshqalarni aks ettiradigan oqsillarni o'z ichiga oladi toksinlar kesib o'tish hujayra membranalari.[8]
Qabul qiluvchilarni majburiy domeni
The C-terminali TcdB ning (2-rasmning yashil hududi) birlashtirilgan takrorlanadigan deb nomlanuvchi hududni o'z ichiga oladi oligopeptidlar O'z ichiga olgan (CROPs) aminokislota qoldiqlari 1831–2366.[9] Ushbu CROPlar aminokislotalarning 19-24 ta qisqa takrorlanishini (SR), taxminan 31 ta takroriy aminokislotalarni (LR) aminokislotalarni, toksin A va Toksin B ni tashkil qiladi.[9][10] TcdB CROPs mintaqasi 19 ta SR va 4 ta LRdan iborat. Ushbu SR va LR mintaqasi hujayra devorlarini bog'lash motiflarini shakllantirishga imkon beradi, bu hujayra yuzalarining shakar qismlarini bog'lashga yordam beradi.[9]
Tozalash
B toksinini tozalash uchun C. difficile hujayra madaniyati, miya yurak infuzion bulon toksin B sintezini kuchaytirgani uchun ishlatiladi.[11] Filtrlash usuli B toksinini dan tozalashni osonlashtiradi superfant ning C. difficile. Toksin diqqat Supernatant organizm hujayralari soniga mutanosibdir. Ko'pgina tadkikotlar shuni ko'rsatadiki, toksinlarning aksariyati kechning o'zida ajralib chiqadi log bosqichi yoki erta statsionar fazalar, shuning uchun B toksin hujayralar tomonidan doimiy ravishda ajralib turadi.[2] B toksinini tozalashda turli xil tadqiqotlarda qo'llaniladigan ko'plab usullar mavjud bo'lsa-da, tadqiqotlarning aksariyati ultrafiltratsiyalangan konsentratsiyani o'z ichiga olgan usullardan foydalanadi. ammoniy sulfat yoki yog'ingarchilik, o'rniga ikkalasi ham jel filtratsiyasi yoki ion almashinadigan xromatografiya. Bundan tashqari, samaradorligi ion almashinadigan xromatografiya usuli TcdA va TcdB o'rtasidagi farqni ajratishga yordam beradi.
Funktsiya
Qachon katalitik treonin qoldiq glyukoziltransferaza oilasini o'chiradi kichik GTPazlar, masalan. The Rho oilasi; Rac va CD42 maqsad ichida hujayralar bezovta qilish signal uzatish funktsiyalarining buzilishiga olib keladigan mexanizmlar aktin sitoskelet, hujayra -hujayra birikmasi va apoptoz (5-rasm).[12][13][14] Rho ning faolligini keltirib chiqaradi aktin stress tolalar. Rac oqsillar membranani chayqash faoliyatini nazorat qiladi va NADPH -oksidaza neytrofil. CD42 tartibga soladi F-aktin filaman shakllanishi filopodiya.
Sitotoksiklik
Bir nechta tadqiqotlar TcdB ning mavjudligini ko'rsatdi sutemizuvchi hujayralar ichidagi tez o'zgarishlarga olib keladi hujayra morfologiya va hujayra signalizatsiyasi. Qisqa vaqt ichida hujayralar TcdB va TcdA ning kichik dozalari bilan blyashka ko'rinishiga ega. Bundan tashqari, hujayralar o'lishi bu toksinlarning hujayralardan keyin katta ta'siridir mast. Donta va boshq. Tomonidan olib borilgan tergov, TcdB kabi boshqa sutemizuvchilar hujayralarida jiddiy ta'sirga ega xitoylik hamster tuxumdon hujayralari, inson bachadon bo'yni epiteliya hujayralari, sichqoncha buyrak usti hujayralar, kalamush gepatotsitlar va kalamush astrotsitlar (3-rasm).[15][16]
The sitotoksik faollik hujayra turlariga asoslangan bo'lib, ular 4 baravaridan 200 baravarigacha bo'lishi mumkin. Odatda, hujayralar TcdB bilan kasallanganda, ular nafaqat strukturaviy yaxlitligini, balki kamayishini ham yo'qotadilar F-aktin iplar.[17] TcdB tomonidan hujayraning yaxlitlashi 2 soatdan ortiq davom etmaydi (4-rasm), lekin shunga qadar hujayralar o'limi ketadi, bu taxminan 24 soat davom etishi mumkin.[15] Haqida Clostridium difficile- assotsiatsiyalangan diareya (CDAD), ta'siri sitopatiklik hujayralarning haqiqiy o'limidan ko'ra muhimroqdir, chunki hujayralar butunligini yo'qotgandan so'ng sitoskelet aktin filamenti, ular ham normal funktsiyasini yo'qotadilar.

Kichik GTPazlarga ta'siri
Ushbu bo'lim haqiqat aniqligi bahsli. (2013 yil iyun) (Ushbu shablon xabarini qanday va qachon olib tashlashni bilib oling) |
Sababi sitotoksik xujayra ichidagi TcdB faolligi asosan retseptorlari orqali amalga oshiriladi endotsitoz[iqtibos kerak ]. Kislota endosomalar toksin B ning kirishiga imkon bering sitozol. Ushbu hodisa a tomonidan sodir bo'ladi majburiy retseptor toksinni xujayra hujayralariga kiritishiga imkon beradigan mintaqa[iqtibos kerak ]. Xost hujayralarining kirish imkoniyati orqali ' sitozol, TcdB o'chiradi kichik GTPazlar (5-rasm), masalan. The Rho oilasi a'zolar Rac va CD42 jarayoni bilan glikosilatsiya ning treonin 35 dyuym CD42 va Rac va treonin Rhoda 37.[18][19] Bular Rho GTPazlari hamma joyda uchraydi sitozol ning eukaryotik hujayralar tashkil etish uchun mas'ul bo'lganlar aktin sitoskelet chunki tarkibidagi toksinlar sitozol kondensatsiyaga olib keladi aktin iplari hujayraning yaxlitlashi va membrana qon ketishining oqibati (3-rasm), bu oxir-oqibat olib keladi apoptoz.[20][21] TcdB hujayra dinamikasi va morfologiya. 3-rasmda toksin B ning hujayra yuzasiga ehtimoliy ta'siri ko'rsatilgan; membranadan qon ketish (qora o'qlar).[22] Bundan tashqari, TcdB Rho GTPazlarni inaktiv qiladi. Natijada, hujayra hujayralarining birlashishi buziladi, bu B toksinining epiteliya o'tkazuvchanligini va lümendagi suyuqlik to'planishini kuchaytiradi. Bu shartnoma tuzishda asosiy sababchi omillardan biridir Clostridium difficile- assotsiatsiyalangan diareya (CDAD) (5-rasm).[23][24]

Bundan tashqari, darajasi gidroliz tomonidan TcdB tomonidan UDP-glyukoza TcdA dan besh baravar katta.[25] Bir nechta tadqiqotlar shuni ko'rsatdiki, Rho eksponatlari tarjimadan keyingi orqali o'zgartirish prenilatsiya va sodir bo'lgan karboksimetilatsiya sitoplazmatik tomoni plazma membranasi, shuning uchun almashinish GTP ga YaIM.[26] TcdB Rho va boshqalar bilan bog'langanda kichik GTPazlar, GTP gidrolizlar ga YaIM, bu GTP bilan bog'liq (faol) YaIMga bog'liq (faol bo'lmagan) ga olib keladi (5-rasm). Bundan tashqari, ushbu almashinuv faoliyati tartibga solinadi guanin hujayra sitozolidagi omillar.[27]
Signal yo'llarida buzilish
Rho ning uyali regulyatsiyasi, Rac va CD42 atrofidan tashqarida ta'sir ko'rsatadi aktin iplari sitoskeletning (4-rasm),[17] Bular kichik GTPazlar tarkibiga kiritilgan hujayra aylanishi orqali signallarni tartibga soluvchi mitogen bilan faollashtirilgan oqsil kinaz kinazalari (MAPKKlar).[28] Kiritilmagan hujayralarning ba'zi fiziologik qismlari aktin iplari, hujayralarni yaxlitlashiga olib kelmasligi yoki hujayralar o'limi darhol, lekin quyi oqimdagi harakatning yomonlashishiga olib kelishi mumkin aktin iplari va nihoyat, hujayralar o'limi.[17]
1993 yilda Shoshan va boshqalar tomonidan o'tkazilgan tadqiqot TcdB bo'lgan hujayralar o'zgarganligini ko'rsatdi fosfolipaza A2 faoliyat. Bu buzilishlardan mustaqil hodisa edi aktin sitoskelet.[29] Shoshan va boshq., Shuningdek, TcdB orqali Rho oqsillarini zararsizlantirish orqali retseptorlari signalizatsiya faoliyatini inhibe qilganligini ko'rsatdi. fosfolipaza D.[29]
Teshiklarning shakllanishi
TcdB hujayraning ichki qismiga kiradi klatrin vositachiligidagi endotsitoz,[30] B toksin qismi tarkibiga kirganda sitozol, glyukoziltransferaza orqali o'tadi endosomal membrana pH qiymatini pasaytiradigan induktsiya qiladi translokatsiya va nihoyat olib keladi morfologik translokatsion mintaqa qoldiqlarining o'zgarishi (958–1130).[31] The hidrofob mintaqalar mezbon membranaga singib, teshiklarni hosil qiladi glyukoziltransferaza o'tadigan domenlar.[31] Kislotali muhitda hujayralar TcdB bilan zararlanganda, u toksinlarni susaytiradi va shaklning o'zgarishini keltirib chiqaradi (6-rasm).[31] Kislotali pH natijasida TcdB ning asl lyuminestsentsiyasida aniq farqlar mavjud triptofan, sezuvchanligi proteazlar va hidrofob yuzalar.[31] Yana bir guruh shuni ko'rsatdiki, kislotalash toksinning konformatsion o'zgarishiga olib keladi va eng muhimi, teshiklarni hosil qilishga yordam beradi.[7] Muvofiqlik translokatsiya mintaqa (2-rasm) taxminan 801-1400 aminokislotani tashkil etadi, ulardan 958–1130 qoldiqlari hidrofob va transmembrana teshiklarining hosil bo'lishi uchun javobgardir.[20] Tadqiqotlarning aksariyati TcdB 630 shtammidan foydalanib, uning teshik hosil bo'lish faolligini ko'rsatdi C. difficile toksinlar.[31]
PH tomonidan induktsiya qilingan
Ning ta'sirini ko'rish uchun proteolitik parchalanish TcdB ning hujayralar yuzasida yoki ichida sodir bo'ladi kislotali endosomalar, ishlatilgan tadqiqotlar Bafilomitsin A1 blokirovkasi ma'lum bo'lgan v tipidagi H+-ATPases endosomalar. Bu endosomalarning kislotaliligini pasaytiradi.[31] The fiziologik TcdB yo'lini to'sib qo'yadi sitopatik TcdB faoliyati.[31] Hujayralar bo'lganida kislotali sharoitlar (pH 4.0) TcdB ni hujayra yuzasiga 37 daraja Selsiy bilan bog'lab qo'ygandan keyin 5 daqiqa davomida shaklni qayta tuzish va yaxlitlash kuzatildi. Shu bilan birga, yumaloq hujayralar qo'shimcha parametrlarga o'xshash neytral pH (7.0) da qo'shimcha soat davomida inkübe qilinganida, hujayraning yaxlitlashi kuzatilmadi.[15][31] Ikkala tadqiqot shuni ko'rsatdiki, toksin B xususiyati bor proteolitik parchalanish ga kirish uchun juda muhimdir sitozol.[7][15][31] PH ning kislotali endosomasiga ega bo'lishi TcdB ning topologik o'zgarishiga olib keladi (6-rasm).[7]

Genetika
TcdB oqsilini kodlovchi gen, tcdB, ichida joylashgan xromosoma 19,6 hududi kb. Bu sifatida tanilgan lokus ning patogenlik yoki PaLoc (2-rasm).[32][33] The ochiq o'qish doirasi TcdB uchun (ORF) - 7,098 nukleotidlar uzunligi bo'yicha.[17] Shuni ta'kidlash kerakki, PaLoc mintaqasidagi asosiy toksin genlaridan tashqari yana uchta aksessuar mavjud genlar PaLoc mintaqasida kodlangan: tcdR (L), tcdC (R) va tcdE o'rtasida. Ushbu genlar TcdA va TcdB ekspressionini boshqarishga yordam beradi. Ular shuningdek, sekretsiyani chiqarishga yoki chiqarishga yordam beradi toksinlar hujayradan.[17] Kodlash gen tcdE, tcdB va tcdA o'rtasida joylashgan, shunga o'xshash Xolin oqsillar, shuning uchun tcdE osonlashtiruvchisi sifatida ishlaydi gen bu TcdA va TcdB ning chiqarilishini yoki sekretsiyasini kuchaytiradi, natijada the o'tkazuvchanlik mezbonning hujayra membranasi.[17]

Toksinni aniqlash
Turli xil narsalar mavjud plazmid ning o'lchamlari C. difficile. Aniqlangan molekulyar og'irliklar 2,7x10 gacha6 100x10 gacha6, lekin plazmid o'lchamlari bilan hech qanday bog'liqlik yo'q toksiklik. Toksin B miqdorini aniqlash uchun C. difficile, klinisyenler keng foydalanadilar hujayra madaniyati bilan kasallangan najas namunalaridan olingan tahlillar PMC.[2][3] Hujayra madaniyati tekshiruvi aniqlash uchun "oltin standart" sifatida qaraladi toksiklik yilda C. difficile chunki oz miqdordagi B toksinlari hujayralarni yaxlitlashiga olib keladi (4-rasm), shuning uchun klinik laboratoriyalarning TcdB keltirib chiqaradigan CDAD bilan o'zaro bog'liqligini ta'minlashning asosiy afzalligi hisoblanadi.[2][3] PMC bemorining najas namunalarida katta klostridial toksinlarning (LKT) sitotoksik faolligi topilgan bo'lsa-da, toksin B faolligi A toksiniga nisbatan ko'proq zararli sitotoksik ta'sirga ega edi.[2] Shuning uchun A toksinining faolligi uni B toksinidan ajratib olinmaganda susayadi.[2][3] Aniqlash C. difficile toksiklik ni ishlatganda juda sezgir hujayra madaniyati tahlil klinik laboratoriyalarga qiyinchiliklarni engishga imkon beradi; 1 pg / ml B toksinidan kam dozalarni qo'llash hujayralarni yaxlitlashiga olib keladi.[2][3] Bu aniqlash uchun madaniy to'qima tahlilidan foydalanishning asosiy afzalligi toksiklik yilda PMC bemorlar.[2] Klinik laboratoriyalar tahlil mikrotiter plitasidan foydalanishga urinishgan bo'lsa ham ferment bilan bog'liq immunosorbentni tahlil qilish (Elishay) va aniqlashning boshqa usullari sitotoksik najasdagi B toksinining faolligi PMC bemorlar, natijalar qaerdagidek aniq emas hujayra madaniyati tahlillar ishlatilgan.[2][3][34]
Ishlab chiqarish omili
Qo'shish orqali mikroblarga qarshi, masalan. klindamitsin, madaniy o'sish muhitida, tadqiqotlar shuni ko'rsatdiki sitotoksik faoliyat C. difficile madaniyatlar 4-8 marta ko'payadi.[35][36] Bundan tashqari, rolini bilish antibiotiklar PMC sabablari bo'yicha ko'plab oldingi tadqiqotlar ta'siriga qaratilgan mikroblarga qarshi vositalar toksinlarni ishlab chiqarish. Natijada, tadqiqotlar subinhibitory nature degan xulosaga kelishdi vankomitsin va penitsillin madaniyati tarkibidagi toksin ishlab chiqarishni ko'paytirmoqda C. difficile.[37] Toksin ishlab chiqarish miqdori organizmlar uchun o'sish muhitidan foydalanish bilan o'zaro bog'liq edi. Boshqa bir tadqiqot shuni ko'rsatdiki, TcdB toksinini ishlab chiqarishning yuqori darajasi miya va yurak infuziyasi kabi murakkab vositalarda kuzatilgan. bulon.[38][39] Yuqori darajada toksinlar yuqori darajada ajratilgan holda ishlab chiqarilgan zararli. Aksincha, kam miqdordagi toksinlar zaifni ajratib olish bilan hosil bo'lgan zararli. Shunday qilib, bu toksinlarning ishlab chiqarilishi birgalikda tartibga solinganligini ko'rsatadi. Toksinlarni ifoda etuvchi signallarni modulyatsiya qilishda atrof-muhitning ishtirok etish mexanizmi tushunilmagan bo'lsa ham, yilda vitro tadqiqotlar shuni ko'rsatdiki, toksin ekspressioni kuchayadi katabolit repressiyasi va stress, masalan. antibiotiklar.[40][41][42] Boshqa bir tadqiqot shuni ko'rsatdiki, cheklash biotin yaxshi tavsiflangan muhitda TcdB ishlab chiqarishni 64 barobarga va TcdA ishlab chiqarishni 35 baravarga oshiradi. Bu bilan qilingan C. difficile va dozalari biotin 0,05nM kabi kichik.[41] Boshqa bir qator dastlabki tadqiqotlar shuni ko'rsatadiki, toksin ishlab chiqarishda stress yoki TcdA yoki TcdB toksinlarining stress yoki katabolit repressiyasi bilan kurashish mumkin.[42] Shuningdek, ko'plab tadqiqotlar shuni ko'rsatadiki, boshqa tadqiqotlar orasidagi farqlarning asosiy sababi toksin ishlab chiqarishning barcha izolatlari bilan sodir bo'lmasligi bilan bog'liq C. difficile.
Klinik ahamiyati
Ko'pgina dastlabki tadqiqotlar shuni ko'rsatadiki, toksin A (TcdA deb ham ataladi) asosiy toksin oqsili antibiotik bilan bog'liq diareya (AAD); ammo, so'nggi o'n yil ichida olib borilgan tadqiqotchi olimlar, Toksin B (yoki TcdB) kasallikda har kim taxmin qilganidan ko'ra muhimroq rol o'ynaydi. Ushbu bilim bilan Toksin B asosiy deb topildi zaharlanish ochilishini keltirib chiqaradigan omil qattiq o'tish joylari ning ichak epiteliy hujayralari, bu toksinni ko'payishiga imkon beradi qon tomirlarining o'tkazuvchanligi va undaydi qon ketish. Demak, bu olib keladi o'sma nekroz omil a (TNF a) va proinflamatuar interleykinlar ning asosiy qo'zg'atuvchisi sifatida tashkil etilgan psevdomembranoz kolit (PMC) va antibiotik bilan bog'liq diareya (AAD).[2][3][43]
A toksinining va eng muhimi B toksinining ishtirok etishi kasallikni aniqlaydigan asosiy element hisoblanadi C. difficile. Klinik laboratoriyalar ushbu toksinlarni bemorlar najasida aniqladilar antikor va sitotoksikani tahlil qilish.[44] Ushbu bakterial toksinlar bilan bog'liqligi isbotlangan Clostridium sordellii gemorragik toksin (TcsH), o'ldiradigan toksin (TcsL) va Clostridium novyi alfa toksin (Tcn a), shuning uchun ushbu kohort toksinlarning katta oilasi klostridialga aylanadi.[17] Ushbu toksinlarning boshqalar bilan o'xshashligi tufayli tadqiqotchilar ularni yirik klostridial toksinlar (LKT) oilasi deb tasnifladilar.[9]
TcdB bilan bezlotoksumab mexanizmi
Bezlotoksumab Clostridium difficile infektsiyalarining takrorlanishining oldini olish uchun mo'ljallangan inson monoklonal antikoridir. TcdB ning N-terminalining rentgen nurlanishida kristallangan tuzilishi bilan toksin uchta domendan iborat: glyukosiltransferaza domeni (GTD), sistein proteaz va qo'shma takrorlanadigan oligopeptid (CROP) domeni. Bezlotoksumab, TcdB ning CROP domenidagi ikkita gomologik sayt bilan bog'lanadi. X-nurli kristallografiya bo'yicha strukturaviy tahlil shuni ko'rsatadiki, antikor bilan bog'lanish, taxminiy uglevodlarni bog'laydigan cho'ntaklarni qisman yopib qo'yadi. Ushbu g'oyaga muvofiq, Bezlotoksumab TcdB ning sutemizuvchi hujayralar bilan birikishini bloklaydi.[45]
Psevdomembranoz kolitdagi roli
Kasallikning dastlabki bosqichlarida PMC, ko'plab tadqiqotlar TcdA ning TcdB ga qaraganda kuchliroq ekanligini taxmin qilishgan. Bu in vivo jonli tajribalar natijasida aniqlandi, bu erda TcdA ning toksin ishlab chiqarilishi antibiotiklar bilan tsitit bilan TcdB ga qaraganda ancha og'ir bo'lgan.[38][46] Keyinchalik, bir nechta tadqiqotlar shuni ko'rsatdiki, TcdB kasalligida katta rol o'ynaydi PMC va qo'shish. Tadqiqot shuni ko'rsatdiki, garchi C. difficile TcdA ishlab chiqarmadi, u hali ham kasallik alomatlarini ko'rsatdi.[47] Bundan tashqari, keyingi tadqiqotlar shuni ko'rsatdiki, TcdB ning tozalangan shakli ko'proq o'limga olib keladi enterotoksin TcdA bilan taqqoslaganda, shuningdek, ichak epiteliyasi jiddiy zarar ko'radi va o'tkir yallig'lanish reaktsiyasini keltirib chiqaradi.[48] Toksinni yaxshiroq tushunish bilan tadqiqotchilar TcdB asosiy ekanligini ta'kidlashdi virulentlik omili bu CDI ni TcdA orqali keltirib chiqaradi. Ammo, agar TcdA ichakda bo'lsa, bu TcdB faoliyatini yanada kengroq ta'sirga ega bo'lishiga yordam beradi, natijada bir nechta organ tizimlariga ta'sir qiladi.[49] Bundan tashqari, hamsterlar TcdAga qarshi emlanganida, hamsterlar to'liq himoyalanmaganligini ko'rsatdi C. difficile kasallik va bu qo'rg'oshin TcdB juda halokatli va kuchli degan xulosaga keladi.[50] Bundan tashqari, kichik dozada TcdA ni o'limga olib keladigan TcdB dozasini kiritish vena ichiga yoki qorin bo'shlig'i hayvonning o'limiga sabab bo'lishi mumkin. Shuning uchun TcdA TcdB ning ichakdan chiqishiga yordamchi sifatida ishlaydi.[50]
Shuningdek qarang
Adabiyotlar
- ^ Reinert DJ, Jank T, Aktories K, Schulz GE (sentyabr 2005). "Funktsiyasining tarkibiy asoslari Clostridium difficile toksin B ". Molekulyar biologiya jurnali. 351 (5): 973–81. doi:10.1016 / j.jmb.2005.06.071. PMID 16054646.
- ^ a b v d e f g h men j Lyerli DM, Krivan XK, Uilkins TD (yanvar 1988). "Clostridium difficile: uning kasalligi va toksinlari ". Klinik mikrobiologiya sharhlari. 1 (1): 1–18. doi:10.1128 / cmr.1.1.1. PMC 358025. PMID 3144429.
- ^ a b v d e f g Bartlett JG (1990). "Clostridium difficile: klinik mulohazalar ". Yuqumli kasalliklar haqida sharhlar. 12 Qo'shimcha 2: S243-51. doi:10.1093 / klinitslar / 12.Qo'shimcha_2.S243. PMID 2406876.
- ^ fon Eichel-Streiber C (1997). "Enterotoksin A va sitotoksin B (Clostridium difficileMontecucco C-da, Rappuoli R (tahrir). Protein toksinlari va ulardan hujayra biologiyasida foydalanish bo'yicha qo'llanma. Oksford [Oksfordshir]: Oksford universiteti matbuoti. p. 72. ISBN 978-0-19-859954-8.
- ^ a b v Albesa-Jové D, Bertran T, Carpenter E.P., Swain GV, Lim J, Zhang J, Haire LF, Vasisht N, Braun V, Lange A, von Eichel-Streiber C, Svergun DI, Fairweather NF, Brown KA (mart 2010) . "To'rt xil tarkibiy domenlar Clostridium difficile SAXS yordamida vizualizatsiya qilingan B toksini ". Molekulyar biologiya jurnali. 396 (5): 1260–70. doi:10.1016 / j.jmb.2010.01.012. PMID 20070948.
- ^ a b Hofmann F, Busch C, Prepens U, Just I, Aktories K (aprel 1997). "Ning glyukoziltransferaza faolligini lokalizatsiya qilish Clostridium difficile holotoksinning N-terminal qismiga B toksini ". Biologik kimyo jurnali. 272 (17): 11074–8. doi:10.1074 / jbc.272.17.11074. PMID 9111001.
- ^ a b v d Barth H, Pfeifer G, Hofmann F, Maier E, Benz R, Aktories K (aprel, 2001). "Ion kanallarining past pH ta'sirida hosil bo'lishi Clostridium difficile maqsadli hujayralardagi B toksini ". Biologik kimyo jurnali. 276 (14): 10670–6. doi:10.1074 / jbc.M009445200. PMID 11152463.
- ^ a b Jank T, Aktories K (may 2008). "Klostridial glyukozilatlovchi toksinlarning tuzilishi va ta'sir qilish tartibi: ABCD modeli". Mikrobiologiya tendentsiyalari. 16 (5): 222–9. doi:10.1016 / j.tim.2008.01.011. PMID 18394902.
- ^ a b v d fon Eichel-Streiber C, Boquet P, Sauerborn M, Thelestam M (oktyabr 1996). "Katta klostridial sitotoksinlar - kichik GTP bilan bog'langan oqsillarni o'zgartiradigan glikosiltransferazalar oilasi". Mikrobiologiya tendentsiyalari. 4 (10): 375–82. doi:10.1016 / 0966-842X (96) 10061-5. PMID 8899962.
- ^ Jank T, Giesemann T, Aktories K (2007 yil aprel). "Rho-glyukosilating Clostridium difficile toksinlari A va B: tuzilishi va faoliyati to'g'risida yangi tushunchalar". Glikobiologiya. 17 (4): 15R-22R. doi:10.1093 / glycob / cwm004. PMID 17237138.
- ^ Meador J, Tweten RK (1988 yil iyul). "B toksinini tozalash va tavsiflash Clostridium difficile". Infektsiya va immunitet. 56 (7): 1708–14. PMC 259466. PMID 3384474.
- ^ Aktories K, Just I (1995 yil dekabr). "Klostridial sitotoksinlar bilan past molekulyar massali GTP bilan bog'langan Rho oqsillarini monoglyukosilatsiyasi". Hujayra biologiyasining tendentsiyalari. 5 (12): 441–3. doi:10.1016 / S0962-8924 (00) 89107-2. PMID 14732022.
- ^ Dillon ST, Rubin EJ, Yakubovich M, Pothoulakis C, LaMont JT, Feig LA, Gilbert RJ (aprel 1995). "Ras bilan bog'liq Rho oqsillarini ta'sir qilish mexanizmlariga jalb qilish Clostridium difficile toksin A va B toksin ". Infektsiya va immunitet. 63 (4): 1421–6. PMC 173169. PMID 7890404.
- ^ Wilkins TD, Lyerly DM (Fevral 1996). "Clostridium difficile toksinlar Rhoga hujum qiladi ". Mikrobiologiya tendentsiyalari. 4 (2): 49–51. doi:10.1016 / 0966-842X (96) 81508-3. PMID 8820565.
- ^ a b v d Pfeifer G, Schirmer J, Leemhuis J, Busch C, Meyer DK, Aktories K, Barth H (Noyabr 2003). "Uyali aloqa Clostridium difficile toksin B. N-terminal katalitik domenning eukaryotik hujayralar sitosoliga o'tkazilishi ". Biologik kimyo jurnali. 278 (45): 44535–41. doi:10.1074 / jbc.M307540200. PMID 12941936.
- ^ Donta ST, Sallivan N, Uilkins TD (iyun 1982). "Ning differentsial ta'siri Clostridium difficile to'qima bilan o'stirilgan hujayralardagi toksinlar ". Klinik mikrobiologiya jurnali. 15 (6): 1157–8. PMC 272271. PMID 7107845.
- ^ a b v d e f g Voth DE, Ballard JD (2005 yil aprel). "Clostridium difficile toksinlar: ta'sir mexanizmi va kasallikdagi roli ". Klinik mikrobiologiya sharhlari. 18 (2): 247–63. doi:10.1128 / CMR.18.2.247-263.2005. PMC 1082799. PMID 15831824.
- ^ Just I, Selzer J, Wilm M, von Eichel-Streiber C, Mann M, Aktories K (iyun 1995). "Rho oqsillarining glyukosillanishi Clostridium difficile toksin B ". Tabiat. 375 (6531): 500–3. doi:10.1038 / 375500a0. PMID 7777059.
- ^ Just I, Wilm M, Selzer J, Rex G, von Eichel-Streiber C, Mann M, Aktories K (iyun 1995). "Enterotoksin Clostridium difficile (ToxA) Rog oqsillarini monoglyukosilat qiladi ". Biologik kimyo jurnali. 270 (23): 13932–6. doi:10.1074 / jbc.270.23.13932. PMID 7775453.
- ^ a b fon Eichel-Streiber C, Warfolomeow I, Knautz D, Sauerborn M, Hadding U (1991 yil noyabr). Tomonidan biriktirilgan hujayralardagi morfologik o'zgarishlar Clostridium difficile toksinlar " (PDF). Biokimyoviy jamiyat bilan operatsiyalar. 19 (4): 1154–60. doi:10.1042 / bst0191154. PMID 1794484.
- ^ Thelestam M, Chaves-Olarte E (2000). Ning sitotoksik ta'siri Clostridium difficile toksinlar. Mikrobiologiya va immunologiyaning dolzarb mavzulari. 250. 85-96 betlar. doi:10.1007/978-3-662-06272-2_4. ISBN 978-3-642-08668-7. PMID 10981358.
- ^ Fiorentini C, Fabbri A, Falzano L, Fattorossi A, Matarrese P, Rivabene R, Donelli G (iyun 1998). "Clostridium difficile toksin B ichakda o'stirilgan hujayralarda apoptozni keltirib chiqaradi ". Infektsiya va immunitet. 66 (6): 2660–5. PMC 108253. PMID 9596731.
- ^ Feltis BA, Wiesner SM, Kim AS, Erlandsen SL, Lyerly DL, Wilkins TD, Wells CL (dekabr 2000). "Clostridium difficile A va B toksinlari epiteliya o'tkazuvchanligini o'zgartirishi va HT-29 enterotsitlari orqali bakteriyalarning paratsellular migratsiyasini kuchaytirishi mumkin ". Shok. 14 (6): 629–34. doi:10.1097/00024382-200014060-00010. PMID 11131913.
- ^ Johal SS, Solomon K, Dodson S, Borriello SP, Mahida YR (iyun 2004). "Ning turli xil kontsentratsiyalarining differentsial ta'siri Clostridium difficile epiteliya to'sig'i funktsiyasi va sitokinlarning ekspressioni bo'yicha A toksini ". Yuqumli kasalliklar jurnali. 189 (11): 2110–9. doi:10.1086/386287. PMID 15143480.
- ^ Ciesla WP, Bobak DA (iyun 1998). "Clostridium difficile A va B toksinlari - katalitik faolligi turlicha bo'lgan kationga bog'liq UDP-glyukoza gidrolazalar ". Biologik kimyo jurnali. 273 (26): 16021–6. doi:10.1074 / jbc.273.26.16021. PMID 9632652.
- ^ Adamson P, Marshall CJ, Hall A, Tilbrook PA (oktyabr 1992). "P21rho oqsillarining translyatsiyadan keyingi modifikatsiyalari". Biologik kimyo jurnali. 267 (28): 20033–8. PMID 1400319.
- ^ Chjou K, Vang Y, Gorski JL, Nomura N, Collard J, Bokoch GM (iyul 1998). "Guanin nukleotidlari almashinuvi omillari Rac va Cdc42 dan pastki oqim signalizatsiyasini tartibga soladi". Biologik kimyo jurnali. 273 (27): 16782–6. doi:10.1074 / jbc.273.27.16782. PMID 9642235.
- ^ Chjan Y, Dong S (2007 yil noyabr). "Mitogen bilan faollashtirilgan kinaz signalizatsiyasining tartibga solish mexanizmlari". Uyali va molekulyar hayot haqidagi fanlar. 64 (21): 2771–89. doi:10.1007 / s00018-007-7012-3. PMID 17726577.
- ^ a b Shoshan MC, Florin I, Thelestam M (1993 yil may). "Uyali fosfolipaza A2 ning faollashishi Clostridium difficile toksin B ". Uyali biokimyo jurnali. 52 (1): 116–24. doi:10.1002 / jcb.240520115. PMID 8320270.
- ^ Papatheodorou P, Zamboglou C, Genisyuerek S, Guttenberg G, Aktories K (may, 2010). "Klostridial glyukozilatuvchi toksinlar hujayralarga klatrin vositachiligidagi endotsitoz orqali kiradi". PLOS ONE. 5 (5): e10673. doi:10.1371 / journal.pone.0010673. PMC 2871790. PMID 20498856.
- ^ a b v d e f g h men Qa'Dan M, Spyres LM, Ballard JD (may 2000). "pH-ga asoslangan konformatsion o'zgarishlar Clostridium difficile toksin B ". Infektsiya va immunitet. 68 (5): 2470–4. doi:10.1128 / IAI.68.5.2470-2474.2000. PMC 97448. PMID 10768933.
- ^ Karter GP, Rood JI, Lyras D (2012 yil yanvar). "A va T toksinlarining zaharlanishida roli Clostridium difficile". Mikrobiologiya tendentsiyalari. 20 (1): 21–9. doi:10.1016 / j.tim.2011.11.003. PMID 22154163.
- ^ Braun V, Hundsberger T, Leukel P, Sauerborn M, von Eichel-Streiber C (1996 yil noyabr). "Patogenlik lokusining yagona integratsiya joyini aniqlash Clostridium difficile". Gen. 181 (1–2): 29–38. doi:10.1016 / S0378-1119 (96) 00398-8. PMID 8973304.
- ^ Musher DM, Manxas A, Jain P, Nuila F, Vaqar A, Logan N, Marino B, Graviss EA (Avgust 2007). "Aniqlash Clostridium difficile toksin: ferment immunoassay natijalarini sitotoksikoz tahlilida olingan natijalar bilan taqqoslash ". Klinik mikrobiologiya jurnali. 45 (8): 2737–9. doi:10.1128 / JCM.00686-07. PMC 1951241. PMID 17567791.
- ^ Nakamura S, Mikawa M, Tanabe N, Yamakava K, Nishida S (1982). "Klindamitsinning sitotoksin ishlab chiqarishga ta'siri Clostridium difficile". Mikrobiologiya va immunologiya. 26 (11): 985–92. doi:10.1111 / j.1348-0421.1982.tb00248.x. PMID 7167065.
- ^ Jorj RH, Jonson M, Youngs D, Burdon DW (1980). "Induktsiya Clostridium difficile antibiotiklar bilan toksin ". Hozirgi ximioterapiya va yuqumli kasalliklar. 2 (1): 955–56.
- ^ Onderdonk AB, Lowe BR, Bartlett JG (oktyabr 1979). "Ekologik stressning ta'siri Clostridium difficile doimiy kultivatsiya paytida toksin miqdori ". Amaliy va atrof-muhit mikrobiologiyasi. 38 (4): 637–41. PMC 243552. PMID 44176.
- ^ a b Lyerli DM, Sallivan NM, Uilkins TD (yanvar 1983). "Fermentlarga bog'liq immunosorbentni tahlil qilish Clostridium difficile toksin A ". Klinik mikrobiologiya jurnali. 17 (1): 72–8. PMC 272577. PMID 6338036.
- ^ Sallivan NM, Pellett S, Uilkins TD (1982 yil mart). "A va B toksinlarini tozalash va tavsiflash Clostridium difficile". Infektsiya va immunitet. 35 (3): 1032–40. PMC 351151. PMID 7068210.
- ^ Dupuy B, Sonenshein AL (yanvar, 1998). "Regulyatsiya qilingan transkripsiyasi Clostridium difficile toksin genlari ". Molekulyar mikrobiologiya. 27 (1): 107–20. doi:10.1046 / j.1365-2958.1998.00663.x. PMID 9466260.
- ^ a b Yamakava K, Karasava T, Ikoma S, Nakamura S (fevral 1996). "Yaxshilash Clostridium difficile biotin cheklangan sharoitda toksin ishlab chiqarish ". Tibbiy mikrobiologiya jurnali. 44 (2): 111–4. CiteSeerX 10.1.1.623.71. doi:10.1099/00222615-44-2-111. PMID 8642571.
- ^ a b Mani N, Dupuy B (2001 yil may). "Toksinlar sintezini tartibga solish Clostridium difficile muqobil RNK polimeraza sigma faktori bilan ". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 98 (10): 5844–9. doi:10.1073 / pnas.101126598. PMC 33301. PMID 11320220.
- ^ Bartlett JG (1994 yil may). "Clostridium difficile: uning enterik kasallik qo'zg'atuvchisi sifatida roli tarixi va organizm haqidagi bilimlarning hozirgi holati ". Klinik yuqumli kasalliklar. 18 Qo'shimcha 4: S265-72. doi:10.1093 / klinitslar / 18. Qo'shimcha_4.S265. PMID 8086574.
- ^ Karter GP, Rood JI, Lyras D (2012 yil yanvar). "A va T toksinlarining zaharlanishida roli Clostridium difficile". Mikrobiologiya tendentsiyalari. 20 (1): 21–9. doi:10.1016 / j.tim.2011.11.003. PMID 22154163.
- ^ Orth P, Xiao L, Hernandez LD, Reichert P, Sheth PR, Beaumont M va boshq. (Iyun 2014). "Clostridium difficile toksin B-neytrallashtiruvchi antikor bezlotoksumabning ta'sir mexanizmi va epitoplari rentgen kristallografiyasi natijasida aniqlandi". Biologik kimyo jurnali. 289 (26): 18008–21. doi:10.1074 / jbc.m114.560748. PMC 4140266. PMID 24821719.
- ^ Arnon SS, Mills DC, Day PA, Henrickson RV, Sallivan NM, Wilkins TD (yanvar 1984). "Achchiqlangan rezus maymunlarning tez o'lishi Clostridium difficile A va B toksinlari: fiziologik va patologik asoslar ". Pediatriya jurnali. 104 (1): 34–40. doi:10.1016 / S0022-3476 (84) 80585-5. PMID 6690674.
- ^ Drudy D, Fanning S, Kyne L (2007 yil yanvar). "Toksin A-manfiy, toksin B-musbat Clostridium difficile". Yuqumli kasalliklar jurnali. 11 (1): 5–10. doi:10.1016 / j.ijid.2006.04.003. PMID 16857405.
- ^ Savidge TC, Pan WH, Newman P, O'Brien M, Anton PM, Pothoulakis C (Avgust 2003). "Clostridium difficile toksin B odam ichagidagi yallig'lanishli enterotoksin ». Gastroenterologiya. 125 (2): 413–20. doi:10.1016 / S0016-5085 (03) 00902-8. PMID 12891543.
- ^ Dobson G, Xiki S, Trinder J (iyun 2003). "Clostridium difficile toksik megakolon, og'ir sepsis va ko'plab organlarning buzilishi sindromini keltirib chiqaradigan kolit ". Reanimatsiya tibbiyoti. 29 (6): 1030. doi:10.1007 / s00134-003-1754-7. PMID 12734650.
- ^ a b Lyerli, DM; Roberts, tibbiyot fanlari doktori; Felps, KJ; Uilkins, TD (1986 yil yanvar). "A va B toksinlarini tozalash va xususiyatlari Clostridium difficile". FEMS Mikrobiologiya xatlari. 33 (1): 31–35. doi:10.1111 / j.1574-6968.1986.tb01206.x.
