MMP1 - MMP1
Matritsali metalloproteinaza-1 (MMP-1) sifatida ham tanilgan interstitsial kollagenaza va fibroblast kollagenaza bu ferment odamlarda kodlanganligi MMP1 gen.[5][6][7] Ushbu gen MMP genlari klasterining bir qismidir, ular 11q22.3 xromosomalariga joylashadi.[5] MMP-1 oqsil sifatida bir hillikka qadar tozalangan va cDNA sifatida klonlangan birinchi umurtqali kollagenaza edi.[8][9]
Strukturaviy xususiyatlar
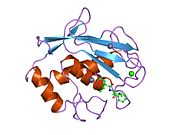
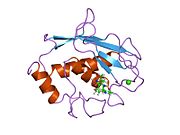
MMP-1 oldindan domen, pro-domen, katalitik domen, bog'lovchi mintaqadan va arxetipik tuzilishga ega. gemopeksin o'xshash domen.[10] MMP-1 ning asosiy tuzilishini birinchi bo'lib Goldberg, G I, va boshq.[9] Hozirgi vaqtda birlamchi tuzilish uchun ikkita asosiy nomenklatura qo'llanilmoqda, ulardan birinchisi birinchi aminokislota signal peptidi bilan boshlanadi, ikkinchisi esa birinchi aminokislota prodomaindan hisoblashni boshlaydi (proenzim nomenklaturasi).
Katalitik domen
MMPlarning katalitik domenlari juda o'xshash xususiyatlarga ega bo'lib, ularning diametri ~ 40 Å bo'lgan oblat ellipsoidning umumiy shakliga ega.[11] MMPlarning katalitik domenlarining o'xshashligiga qaramay, ushbu yozuv faqat MMP-1 katalitik domenining strukturaviy xususiyatlariga e'tibor qaratadi.
Umumiy tuzilish xususiyatlari
MMP-1 ning katalitik domeni beshta o'ta buralgan b-iplardan (sI-sV), uchta a-spiraldan (hA-hC) va jami sakkizta ilmoqdan iborat bo'lib, ular jami beshta metall ionlarini, uchta Ca ni o'z ichiga oladi.2+ va ikkita Zn2+, ulardan biri katalitik rolga ega.[12]
MMP-1 katalitik domeni (CAT) CAT domenining N-terminal tsiklining birinchi aminokislota sifatida F100 (kesilmagan CAT) bilan boshlanadi. CAT domenining birinchi nashr etilgan rentgen tuzilishi ushbu domenning qisqartirilgan shakli vakili bo'lib, u erda birinchi 7 ta aminokislotalar mavjud emas.[12]
Dastlabki tsikldan keyin ketma-ketliklar birinchi va eng uzun b-varaqqa (sI) to'g'ri keladi. Ikkinchi tsikl oqsil joyini uzunlamasına qamrab oladigan katta "amfipatik a-spiral" (hA) dan oldin. SII va sIII chiziqlar tegishli tsikllar bilan ajralib turadi, 4-tsikl odatda "qisqa halqa" sifatida belgilanadi, sII-sIII-ga ko'prik. SIII ipdan keyin ketma-ketlik peptid tuzilishi va katalitik faolligi uchun birinchi o'ringa ega bo'lgan "S shaklidagi qo'shaloq halqa" bilan to'qnashadi (qarang), chunki u yoriq tomonga "bo'rtma" tomon cho'zilib, yagona antiparallel g-ipga davom etadi. sIV, bu asosiy zanjir hosil qilib peptidli substratlar yoki ingibitorlarni bog'lash uchun juda muhimdir vodorod aloqasi. SIVdan keyin Gln186-Gly192 va b-strand sV oqsil tarkibidagi bir nechta metall ionlariga ko'plab ligandlar bilan qo'shilish uchun javobgardir (batafsil o'qing). Katta ochiq tsikl, MMPlar oilasida substratning o'ziga xosligi muhimligini isbotlagan sV-ni kuzatib boradi.[13] Kollagenolitik faollikni ifodalash uchun metalloproteinaza 1 matritsasining muhim segmenti sifatida ma'lum bir mintaqa (183) RWTNNFREY (191) aniqlandi.[14] CAT domenining C-terminal qismida "faol joy spirali" deb nomlanuvchi hB a-spiral "sink bog'lovchi konsensus ketma-ketligi" ning HEXXHXXGXXH qismini o'z ichiga oladi. Metzincin superfamily.[15][16] A-spiral hB domenning so'nggi tsikli boshlanadigan Gly225 da to'satdan tugaydi. Ushbu so'nggi tsiklda MMPlar oilasida eng qisqa bo'lgan "o'ziga xoslik davri" mavjud. Katalitik domen a-spiral hC bilan Gly261 da tugaydi.
Funktsiya
MMPlar buzilishida ishtirok etmoqda hujayradan tashqari matritsa normal fiziologik jarayonlarda, masalan, embrional rivojlanish, ko'payish va to'qimalarni qayta qurish, shuningdek artrit va metastaz kabi kasallik jarayonlarida. Xususan, MMP-1 interstitsialni buzadi kollagenlar, I, II va III turlari.
 Matritsali metalloproteinaza induksiyasi 1 dyuym kalamush shox parda siprofloksatsin, ofloksatsin va levofloksatsin (b, c, d) bilan taqqoslaganda sun'iy ko'z yoshlar (a). Reviglio va boshq., 2003 y. |
Tartibga solish
Mexanik kuch insonning periodontal ligament hujayralarida MMP1 ekspressionini oshirishi mumkin.[17]
O'zaro aloqalar
MMP1 ga ko'rsatildi o'zaro ta'sir qilish bilan CD49b.[18][19]
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000196611 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000043089 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ a b EntrezGene 4312
- ^ Brinckerhoff CE, Ruby PL, Ostin SD, Fini ME, White HD (1987 yil fevral). "Odamning sinovial hujayra kollagenazini molekulyar klonlash va genomik DNKdan bitta genni tanlash". J. klinikasi. Investitsiya. 79 (2): 542–6. doi:10.1172 / JCI112845. PMC 424122. PMID 3027129.
- ^ Pendas AM, Santamariya I, Alvarez MV, Pritchard M, Lopes-Otin S (1996 yil oktyabr). "11q22.3 xromosomasida to'plangan inson matritsasi metalloproteinaza genlarining fizik xaritasini tuzish". Genomika. 37 (2): 266–8. doi:10.1006 / geno.1996.0557. PMID 8921407.
- ^ Gross J, Lapiere CM (iyun 1962). "Amfibiya to'qimalarida kollagenolitik faollik: to'qima madaniyatini tahlil qilish". Proc. Natl. Akad. Ilmiy ish. AQSH. 48 (6): 1014–22. doi:10.1073 / pnas.48.6.1014. PMC 220898. PMID 13902219.
- ^ a b Goldberg GI, Wilhelm SM, Kronberger A, Bauer EA, Grant GA, Eisen AZ (may 1986). "Inson fibroblast kollagenazasi. Onkogen transformatsiyasiga bog'liq bo'lgan kalamush oqsilining to'liq birlamchi tuzilishi va homologiyasi". J. Biol. Kimyoviy. 261 (14): 6600–5. PMID 3009463.
- ^ Li J, Brick P, O'Hare MC, Skarzinski T, Lloyd LF, Curry VA, Klark IM, Bigg HF, Hazleman BL, Cawston TE (iyun 1995). "To'liq cho'chqaning sinovial kollagenazining tuzilishida kaltsiy bilan bog'langan, to'rtta pichoqli beta-pervanni o'z ichiga olgan C-terminal domeni aniqlanadi". Tuzilishi. 3 (6): 541–9. doi:10.1016 / S0969-2126 (01) 00188-5. PMID 8590015.
- ^ Tallant C, Marrero A, Gomis-Rüth FX (2010 yil yanvar). "Matritsali metalloproteinazlar: katlama va ularning katalitik domenlari funktsiyasi". Biokimyo. Biofiz. Acta. 1803 (1): 20–8. doi:10.1016 / j.bbamcr.2009.04.003. PMID 19374923.
- ^ a b Spurlino JC, Smallwood AM, Carlton DD, Banks TM, Vavra KJ, Johnson JS, Cook ER, Falvo J, Wahl RC, Pulvino TA (iyun 1994). "1.56 etuk kesilgan inson fibroblast kollagenaza tuzilishi". Oqsillar. 19 (2): 98–109. doi:10.1002 / prot.340190203. PMID 8090713. S2CID 23973090.
- ^ Maskos K, Bode V (2003 yil noyabr). "Matritsali metalloproteinazalar va metalloproteinazalarning to'qima inhibitörlerinin tuzilish asoslari". Mol. Biotexnol. 25 (3): 241–66. doi:10.1385 / MB: 25: 3: 241. PMID 14668538. S2CID 24110599.
- ^ Chung L, Shimokava K, Dinakarpandian D, Grams F, Fields GB, Nagase H (sentyabr 2000). "(183) RWTNNFREY (191) mintaqasini kollagenolitik faollikni ifodalash uchun metalloproteinaza 1 matritsasining muhim segmenti sifatida aniqlash". J. Biol. Kimyoviy. 275 (38): 29610–7. doi:10.1074 / jbc.M004039200. PMID 10871619.
- ^ Bode V, Gomis-Ryth FX, Stockler V (sentyabr 1993). "Astatsinlar, serralisinlar, ilon zahari va matritsali metalloproteinazalar bir xil rux bilan bog'lanish muhitini (HEXXHXXGXXH va Met-turn) namoyish etadi va ularni umumiy" metzintsinlar "oilasiga birlashtirish kerak.'". FEBS Lett. 331 (1–2): 134–40. doi:10.1016 / 0014-5793 (93) 80312-I. PMID 8405391. S2CID 27244239.
- ^ Stöcker V, Grams F, Baumann U, Reynemer P, Gomis-Ryth FX, McKay DB, Bode V (may 1995). "Metzintsinlar - astatsinlar, adamalizinlar, serralisinlar va matritsinlar (kollagenazalar) o'rtasidagi topologik va ketma-ket aloqalar sink-peptidazalarning superfamilasini belgilaydi". Protein ilmiy. 4 (5): 823–40. doi:10.1002 / pro.5560040502. PMC 2143131. PMID 7663339.
- ^ Xuang SF, Li YH, Ren YJ, Cao ZG, Long X (avgust 2008). "Matritsadagi metalloproteinaza-1 (MMP-1) promotoridagi bitta nukleotid polimorfizmining inson periodontal ligament hujayralarida kuch ta'sirida paydo bo'lgan MMP-1 ekspresiyasiga ta'siri". Yevro. J. Oral Sci. 116 (4): 319–23. doi:10.1111 / j.1600-0722.2008.00552.x. PMID 18705799.
- ^ Stricker TP, Dumin JA, Dikeson SK, Chung L, Nagase H, Parks WC, Santoro SA (avgust 2001). "Alfa (2) integralin I domeni / prokollagenaza-1 (matritsali metalloproteinaz-1) o'zaro ta'sirining strukturaviy tahlili". J. Biol. Kimyoviy. 276 (31): 29375–81. doi:10.1074 / jbc.M102217200. PMID 11359774.
- ^ Dyumin JA, Dikkson SK, Stricker TP, Bhattacharyya-Pakrasi M, Roby JD, Santoro SA, Parks WC (Avgust 2001). "Pro-kollagenaza-1 (matritsali metalloproteinaza-1) alfa (2) beta (1) integralni I turdagi kollagenga o'tuvchi keratinotsitlardan bo'shatilganda bog'laydi". J. Biol. Kimyoviy. 276 (31): 29368–74. doi:10.1074 / jbc.M104179200. PMID 11359786.
Qo'shimcha o'qish
- Krane SM (1995). "Kollagenaza (matritsa metalloproteinaz-1) suyak va boshqa biriktiruvchi to'qimalarni qayta qurish uchun kerakmi?". Klinika. Orthop. Relat. Res. (313): 47–53. PMID 7641497.
- Massova I, Kotra LP, Fridman R, Mobashery S (1998). "Matritsali metalloproteinazalar: tuzilmalar, evolyutsiya va diversifikatsiya". FASEB J. 12 (25n26): 1075-95. CiteSeerX 10.1.1.31.3959. doi:10.1142 / S0217984998001256. PMID 9737711.
- Nagase H, Woessner JF (1999). "Matritsali metalloproteinazalar". J. Biol. Kimyoviy. 274 (31): 21491–4. doi:10.1074 / jbc.274.31.21491. PMID 10419448.
- Okada Y, Xashimoto G (2001). "[Hujayradan tashqari matritsaning matritsali metalloproteinazalar bilan parchalanishi va bo'g'imlarning yo'q qilinishi]". Seykakaku. 73 (11): 1309–21. PMID 11831026.
- Seiki M (2003). "Membrana tipidagi 1-matritsali metalloproteinaza: o'simta invaziyasining asosiy fermenti". Saraton Lett. 194 (1): 1–11. doi:10.1016 / S0304-3835 (02) 00699-7. PMID 12706853.
- Golubkov VS, Strongin AY (2007). "Proteoliz tomonidan boshqariladigan onkogenez". Hujayra aylanishi. 6 (2): 147–50. doi:10.4161 / cc.6.2.3706. PMID 17245132.
Tashqi havolalar
- The MEROPS peptidazalar va ularning inhibitorlari uchun onlayn ma'lumotlar bazasi: M10.001
- Da mavjud bo'lgan barcha tarkibiy ma'lumotlarga umumiy nuqtai PDB uchun UniProt: P03956 (Interstitsial kollagenaza) da PDBe-KB.