SOD1 - SOD1
Superoksid dismutazasi [Cu-Zn] shuningdek, nomi bilan tanilgan superoksid dismutaz 1 yoki SOD1 bu ferment odamlarda kodlanganligi SOD1 gen, joylashgan 21-xromosoma. SOD1 uchta odamdan biridir superoksid parchalanadi.[5][6] Bunga aloqador apoptoz va oilaviy amiotrofik lateral skleroz.[6]
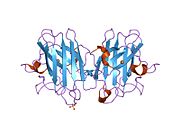
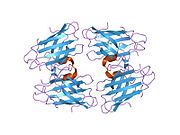
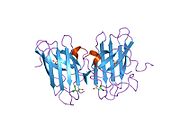
Tuzilishi
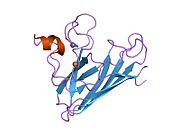
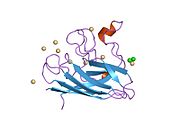
SOD1 - 32 kDa homodimer b-bochka hosil qiladigan va har bir bo'linmada molekula ichidagi disulfid bog'lanishini va yadroli Cu / Zn uchastkasini o'z ichiga olgan. Ushbu Cu / Zn uchastkasi mis va rux ionini ushlab turadi va katalizator uchun javobgardir nomutanosiblik ning superoksid ga vodorod peroksid va dioksigen.[7][8] Ushbu oqsilning pishib etish jarayoni murakkab va to'liq tushunilmagan bo'lib, mis va rux ionlarining selektiv bog'lanishini, ichki birlikning hosil bo'lishini o'z ichiga oladi. disulfid birikmasi Cys-57 va Cys-146 o'rtasida va ikkita subbirlikning dimerizatsiyasi. Sod1 (CCS) uchun mis chaperone mis kiritilishini va disulfid oksidlanishini osonlashtiradi. SOD1 sitosolda sintezlanib, u erda pishib yetishi mumkin bo'lsa-da, ifoda etilgan va hali pishmagan bo'lsa ham, mitoxondriyaga yo'naltirilgan SOD1 membranalararo bo'shliqqa kiritilishi kerak. U erda u kamolotga etishish uchun zarur bo'lgan disulfid bog'lanishini hosil qiladi, garchi metalllashmasa ham.[8] Yetilgan oqsil juda barqaror,[9] ammo uning tarkibida metallsiz va disulfid kamaytirilgan shakllarda beqaror.[7][8][9] Bu in vitro holda namoyon bo'ladi, chunki metall ionlarining yo'qolishi SOD1 agregatsiyasini kuchayishiga olib keladi va kasallik modellarida erimaydigan SOD1 uchun past metallanish kuzatiladi. Bundan tashqari, sirt ta'sirida kamaytirilgan sisteinlar disulfidda ishtirok etishi mumkin o'zaro bog'liqlik va shuning uchun yig'ilish.[7]
Funktsiya
SOD1 mis va rux ionlarini bog'laydi va bepul yo'q qilish uchun javobgar bo'lgan uchta superoksid dismutazadan biridir superoksid tanadagi radikallar. Kodlangan izozim eriydi sitoplazmatik va mitoxondrial tabiiy, ammo zararli superoksid radikallarini molekulyar kislorodga aylantirish uchun homodimer vazifasini bajaruvchi membranalararo kosmik oqsil vodorod peroksid.[8][10] Keyin vodorod peroksidni katalaza deb nomlangan boshqa ferment ajratishi mumkin.
SOD1 ga postulyatsiya qilingan mahalliylashtirish uchun tashqi mitoxondriyal membrana (OMM), bu erda superoksid anionlari hosil bo'ladi yoki membranalararo bo'shliq. Uni lokalizatsiya qilishning aniq mexanizmlari noma'lum bo'lib qolmoqda, ammo uning OMM bilan birlashishi uning BCL-2 bilan bog'liqligi bilan bog'liq. Wildtype SOD1 asab madaniyatida antapoptotik xususiyatlarini namoyish etdi, mutant SOD1 esa orqa miya mitoxondriyasida apoptozni kuchaytirgani kuzatildi, ammo jigar mitoxondriya, garchi u ikkalasida ham teng ifoda etilgan bo'lsa. Ikkita model SOD1 bilan ta'sir o'tkazish orqali apoptozni inhibe qiladi BCL-2 oqsillar yoki mitoxondriyaning o'zi.[6]
Klinik ahamiyati
Oksidlanish stresidagi roli
Eng muhimi, SOD1 muhim ahamiyatga ega reaktiv kislorod turlari (ROS) ishemiya-reperfuzion shikastlanish bilan oksidlovchi stress paytida, xususan miokardda yurak xuruji (shuningdek, nomi bilan tanilgan yurak ishemik kasalligi ). Natijasida kelib chiqadigan ishemik yurak kasalligi okklyuziya yiriklardan biri koronar arteriyalar, hozirgi kunda ham sabablarning asosiy sababidir kasallanish va o'lim g'arbiy jamiyatda.[11][12] Ishemiya reperfuziyasi paytida ROS ajralib chiqishi hujayraga bevosita ta'sir qilish orqali va shuningdek apoptotik signallar orqali hujayraning shikastlanishiga va o'limiga katta hissa qo'shadi. SOD1 ning ROS ning zararli ta'sirini cheklash qobiliyati borligi ma'lum. Shunday qilib, SOD1 kardioprotektiv ta'sirida muhimdir.[13] Bundan tashqari, SOD1 ishemiya-reperfuziya shikastlanishiga qarshi kardio-himoya qilishda ishtirok etgan, masalan ishemik oldindan shartlash yurak.[14] ROSning katta portlashi hujayraning shikastlanishiga olib kelishi ma'lum bo'lsa-da, ishemiyaning o'lik bo'lmagan qisqa epizodlari paytida paydo bo'ladigan mitoxondriyadan ROS ning mo''tadil chiqarilishi, ishemik old shartning signal o'tkazuvchanlik yo'llarida muhim tetiklantiruvchi rol o'ynashi mumkin. hujayraning shikastlanishi. Hatto ROS ning chiqarilishi paytida SOD1 apoptotik signalizatsiya va hujayralar o'limini tartibga soluvchi muhim rol o'ynashi kuzatilgan.
Bir tadqiqotda genning o'chirilishi haqida ikkita oilaviy holat qayd etilgan keratokonus.[15] SOD1 etishmayotgan sichqonlar yoshga bog'liq mushaklarning massa yo'qotilishini kuchaytirdi (sarkopeniya ), erta rivojlanishi katarakt, makula degeneratsiyasi, timik involyutsiya, jigar hujayralari karsinomasi va qisqartirilgan umr.[16] Tadqiqotlar shuni ko'rsatadiki, SOD1 darajasining oshishi surunkali kasallik uchun biomarker bo'lishi mumkin og'ir metallarning toksikligi uzoq muddatli ayollarda tish amalgami plombalarning.[17]
Amiotrofik lateral skleroz (Lou Gehrig kasalligi)
Ushbu gendagi mutatsiyalar (150 dan ortiq aniqlangan), oilaviy bilan bog'liq amiotrofik lateral skleroz.[18][19][20] Shu bilan birga, bir nechta dalillar shuni ko'rsatadiki, yovvoyi turdagi SOD1, uyali stress sharoitida, ALS bilan kasallangan bemorlarning 90 foizini tashkil etuvchi sporadik ALS holatlarining muhim qismiga ta'sir qiladi.[21]Eng tez-tez uchraydigan mutatsiya A4V (AQShda) va H46R (Yaponiya). Faqat Islandiyada SOD1-G93S topildi. ALS sichqonchasining eng ko'p o'rganilgan modeli G93A. Ushbu gen uchun nodir transkript variantlari haqida xabar berilgan.[10]
ALSni keltirib chiqaradigan deyarli ma'lum bo'lgan SOD1 mutatsiyalari a da harakat qiladi dominant moda; kasallikni keltirib chiqarish uchun SOD1 genining bitta mutant nusxasi etarli. SOD1 mutatsiyasining kasallikka olib keladigan aniq molekulyar mexanizmi (yoki mexanizmlari) noma'lum. Bu qandaydir toksik funktsiyaga o'xshaydi,[20] chunki ko'plab kasallik bilan bog'liq bo'lgan SOD1 mutantlari (shu jumladan G93A va A4V) fermentativ faollikni saqlab qoladi va Sod1 nokautli sichqonlari ALSni rivojlantirmaydi (garchi ular yoshga bog'liq distal motorli neyropatiyani namoyon qilsalar ham).
ALS a neyrodejenerativ kasallik tanlab yo'qotish bilan tavsiflanadi vosita neyronlari sabab bo'ladi mushak atrofiyasi. The DNK oksidlanish mahsulot 8-OHdG ning yaxshi tasdiqlangan markeridir oksidlovchi DNK shikastlanishi. 8-OHdG mitoxondriya orqa miya vosita neyronlari ALS bilan kasallanganlar.[22] Yilda transgenik Mutant SOD1 genini saqlaydigan ALS sichqonlari, 8-OHdG ham to'planib qoladi mitoxondrial DNK o'murtqa vosita neyronlari.[23] Ushbu topilmalar shuni ko'rsatadiki, o'zgartirilgan SOD1 tufayli motor neyronlarning mitoxondriyal DNKsiga oksidlanish shikastlanishi ALS etiologiyasida muhim omil bo'lishi mumkin.
A4V mutatsiyasi
A4V (alanin kodonda 4 ga o'zgartirildi valin ) AQSh aholisida ALSni keltirib chiqaradigan eng keng tarqalgan mutatsiyadir, SOD1-ALS bemorlarining taxminan 50% A4V mutatsiyasiga ega.[24][25][26] AQShdagi oilaviy ALS holatlarining taxminan 10 foiziga SOD1 tarkibidagi heterozigot A4V mutatsiyalari sabab bo'ladi. Mutatsiya Amerikadan tashqarida kamdan-kam uchraydi.
Yaqinda A4V mutatsiyasi 540 avlod (~ 12000 yil) oldin sodir bo'lgan deb taxmin qilingan. Mutatsiya atrofidagi haplotip shuni ko'rsatadiki, A4V mutatsiyasi amerikaliklarning osiyolik ajdodlarida paydo bo'lgan, ular Amerikaga Bering bo'g'ozi.[27]
A4V mutanti WT ga o'xshash mutantlarga tegishli. A4V mutatsiyasiga ega bo'lgan bemorlarda o'zgaruvchan yoshi, ammo kasallikning tezligi bir xil, 1,4 yil boshlanganidan keyin o'rtacha omon qolish darajasi (boshqa dominant SOD1 mutatsiyalari bilan 3-5 yilga nisbatan, va ba'zi hollarda H46R kabi, ancha uzoqroq). Ushbu omon qolish mutant bo'lmagan SOD1 bilan bog'langan ALSga qaraganda ancha qisqa.
H46R mutatsiyasi
H46R (histidin kodonda 47 ga o'zgartirildi arginin ) Yaponiya populyatsiyasida ALSni keltirib chiqaradigan eng keng tarqalgan mutatsiyadir, bu mutatsiyani Yaponiyaning SOD1-ALS bemorlarining taxminan 40% olib boradi. H46R faol maydonda mis bilan bog'lanishni chuqur yo'qotishiga olib keladi SOD1va shunga o'xshash tarzda H46R fermentativ ravishda faol emas. Ushbu mutatsiyaning kasallik davri o'ta uzoq, boshlanishidan o'limigacha odatda 15 yoshdan oshgan.[28] Ushbu mutatsiyaga ega sichqon modellari G93A va G37R ALS sichqonlarida kuzatilgan klassik mitoxondriyal vakuolatsiya patologiyasini namoyish etmaydi va G93A sichqonlaridan farqli o'laroq, asosiy mitoxondriyal antioksidant ferment etishmovchiligi, SOD2, ularning kasallik kursiga hech qanday ta'sir ko'rsatmaydi.[28]
G93A mutatsiyasi
G93A (glitsin 93 alanin bilan almashtirilgan) nisbatan kam uchraydigan mutatsiya, ammo juda intensiv ravishda o'rganilgan, chunki bu sichqonlarda modellashtirilgan birinchi mutatsiya edi. G93A - bu ferment faolligini buzilmasdan qoldiradigan psevdo-WT mutatsiyasi.[26] G93A sichqonchasi tayyorligi sababli Jekson laboratoriyasi, ushbu modelda giyohvand moddalarning potentsial maqsadlari va toksiklik mexanizmlari bo'yicha ko'plab tadqiqotlar o'tkazildi. Kamida bitta xususiy tadqiqot instituti (ALS terapiyasini rivojlantirish instituti ) faqat ushbu sichqoncha modelida keng miqyosli dori-darmonlarni namoyish qilmoqda. Topilmalar G93A uchun xosmi yoki SOD1 mutatsiyasiga olib keladigan barcha ALSga taalluqli bo'ladimi, hozircha noma'lum. G93A sichqonining ba'zi patologik xususiyatlari haddan tashqari ekspression artefaktlari, xususan mitoxondriyal vakuolatsiya bilan bog'liqligi bilan bog'liq (ilgari Jekson laboratoriyasida ishlatiladigan G93A sichqonchasida odam SOD1 genining 20 dan ortiq nusxasi bor).[29] Kamida bitta tadqiqot shuni ko'rsatdiki, patologiyaning ba'zi xususiyatlari G93A uchun o'ziga xosdir va ALSni keltirib chiqaradigan barcha mutatsiyalar uchun ekstrapolyatsiya qilinmaydi.[28] Keyingi tadqiqotlar shuni ko'rsatdiki, G93A va H46R modellarining patogenezi aniq ajralib turadi; bir modelda juda foydali / zararli bo'lgan ba'zi dorilar va genetik aralashuvlar, aksincha yoki boshqasiga ta'sir qilmaydi.[30][31][32]
Daun sindromi
Daun sindromi (DS) sabab bo'ladi 21-xromosomaning uch marta ko'payishi. Oksidlanish stressi DS bilan bog'liq patologiyalarning asosiy omilidir. Oksidlanish stressi 21-xromosomada joylashgan SOD1 genining uch baravar ko'payishi va ekspressionining ko'payishi bilan bog'liq. Aftidan, SOD1 ning ko'payishi, ishlab chiqarishni ko'payishiga olib kelishi mumkin. vodorod peroksid uyali shikastlanishning kuchayishiga olib keladi.
8-OHdG darajalari DNK DS bilan kasallangan shaxslarning o'lchovlari tupurik, nazorat guruhlariga qaraganda ancha yuqori ekanligi aniqlandi.[33] 8-OHdG darajasi ham oshdi leykotsitlar DS bilan kasallanganlarni nazorat qilish bilan taqqoslaganda.[34] Ushbu topilmalar oksidlovchi DNK shikastlanishi DS ning ba'zi klinik xususiyatlariga olib kelishi mumkinligini ko'rsatmoqda.
O'zaro aloqalar
SOD1 ga ko'rsatildi o'zaro ta'sir qilish bilan CCS[35] va Bcl-2.[36][37][38][39]
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000142168 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000022982 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ Milani P, Gagliardi S, Cova E, Cereda C (2011). "SOD1 transkripsiyasi va posttranskripsiyasini tartibga solish va uning ALSdagi potentsial ta'siri". Nevrologiya tadqiqotlari xalqaro. 2011: 1–9. doi:10.1155/2011/458427. PMC 3096450. PMID 21603028.
- ^ a b v Rosen DR, Siddique T, Patterson D, Figlewicz DA, Sapp P, Hentati A, Donaldson D, Goto J, O'Regan JP, Deng HX (mart 1993). "Cu / Zn superoksid dismutaz genidagi mutatsiyalar oilaviy amiotrofik lateral skleroz bilan bog'liq". Tabiat. 362 (6415): 59–62. Bibcode:1993 yil 362 ... 59R. doi:10.1038 / 362059a0. PMID 8446170. S2CID 265436.
- ^ a b v Estácio SG, Leal SS, Cristóão JS, Faisca PF, Gomes CM (fevral, 2015). "Kaltsiy kaltsiyni biriktiruvchi moyil segmentlar yonidagi darvozabon qoldiqlari bilan biriktirishi superoksid dismutaz 1 (SOD1) tarkibidagi fibrillyar bo'lmagan amiloid belgilar asosida yotadi". Biochimica et Biofhysica Acta (BBA) - Oqsillar va Proteomikalar. 1854 (2): 118–26. doi:10.1016 / j.bbapap.2014.11.005. PMID 25463043.
- ^ a b v d Sea K, Sohn SH, Durazo A, Sheng Y, Shaw BF, Cao X, Taylor AB, Whitson LJ, Holloway SP, Hart PJ, Cabelli DE, Gralla EB, Valentine JS (yanvar 2015). "Mis-sink superoksid dismutazadagi g'ayrioddiy disulfid bog'lanishining roli to'g'risida tushunchalar". Biologik kimyo jurnali. 290 (4): 2405–18. doi:10.1074 / jbc.M114.588798. PMC 4303690. PMID 25433341.
- ^ a b Khare SD, Caplow M, Dokholyan NV (2004 yil oktyabr). "Amiotrofik lateral sklerozda superoksid dismutazni to'plash uchun ko'p bosqichli reaktsiya ketma-ketligi tezligi va muvozanat konstantalari". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 101 (42): 15094–9. Bibcode:2004 yil PNAS..10115094K. doi:10.1073 / pnas.0406650101. PMC 524068. PMID 15475574.
- ^ a b "Entrez Gen: SOD1 superoksid dismutaz 1, eruvchan (amiotrofik lateral skleroz 1 (kattalar))".
- ^ Murray CJ, Lopez AD (may 1997). "1990-2020 yillarga kelib o'lim va nogironlikning muqobil proektsiyalari: Kasalliklarni o'rganish global yuki". Lanset. 349 (9064): 1498–504. doi:10.1016 / S0140-6736 (96) 07492-2. PMID 9167458. S2CID 10556268.
- ^ Braunvald E, Kloner RA (1985 yil noyabr). "Miyokard reperfuziyasi: ikki qirrali qilich?". Klinik tadqiqotlar jurnali. 76 (5): 1713–9. doi:10.1172 / JCI112160. PMC 424191. PMID 4056048.
- ^ Maslov LN, Narjnayya NV, Podoksenov IuK, Prokudina ES, Gorbunov AS, Zhang I, Peĭ ZhM (2015 yil yanvar). "[Kislorodning reaktiv turlari ishemiya-reperfuziya ta'siriga yurak bag'rikengligining oshishi va vositachisi hisoblanadi]". Rossiĭskii Fiziologicheskiĭ Jurnal Imeni I.M.Sechenova / Rossiĭskaia Akademiia Nauk. 101 (1): 3–24. PMID 25868322.
- ^ Liem DA, Honda HM, Zhang J, Woo D, Ping P (dekabr 2007). "Ishemiya-reperfuziya shikastlanishiga qarshi kardioprotektsiya o'tmishi va hozirgi kursi". Amaliy fiziologiya jurnali. 103 (6): 2129–36. doi:10.1152 / japplphysiol.00383.2007. PMID 17673563.
- ^ Udar N, Atilano SR, Brown DJ, Holguin B, Small K, Nesburn AB, Kenney MC (avgust 2006). "SOD1: keratokonus uchun nomzod gen". Tergovchi oftalmologiya va vizual fan. 47 (8): 3345–51. doi:10.1167 / iovs.05-1500. PMID 16877401.
- ^ Myuller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (avgust 2007). "Oksidlanish qarish nazariyalarining tendentsiyalari". Bepul radikal biologiya va tibbiyot. 43 (4): 477–503. doi:10.1016 / j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Cabaña-Muñoz ME, Parmigiani-Izquierdo JM, Bravo-Gonsales LA, Kyung HM, Merino JJ (iyun 2015). "Zn / Glutation darajalarining ortishi va yuqori superoksid dismutaza-1 faolligi, uzoq muddatli stomatologik amalgam plombali ayollarda oksidlovchi stressning biomarkerlari sifatida: plazmadagi simob / alyuminiy darajalari (sochlarda) va antioksidant tizimlar o'rtasidagi o'zaro bog'liqlik". PLOS ONE. 10 (6): e0126339. Bibcode:2015PLoSO..1026339C. doi:10.1371 / journal.pone.0126339. PMC 4468144. PMID 26076368.
- ^ Conwit RA (2006 yil dekabr). "Oilaviy ALSning oldini olish: klinik sinovni amalga oshirish mumkin, ammo samaradorlik sinovi kafolatlanganmi?". Nevrologiya fanlari jurnali. 251 (1–2): 1–2. doi:10.1016 / j.jns.2006.07.009. PMID 17070848. S2CID 33105812.
- ^ Al-Chalabi A, Ley PN (2000 yil avgust). "Amiotrofik lateral sklerozning so'nggi yutuqlari". Nevrologiyaning hozirgi fikri. 13 (4): 397–405. doi:10.1097/00019052-200008000-00006. PMID 10970056. S2CID 21577500.
- ^ a b Redler RL, Dokholyan NV (2012-01-01). "Amiotrofik lateral skleroz (ALS) kompleks molekulyar biologiyasi". Neyrodejenerativ kasalliklarning molekulyar biologiyasi. Molekulyar biologiya va tarjima fanida taraqqiyot. 107. 215-62 betlar. doi:10.1016 / B978-0-12-385883-2.00002-3. ISBN 9780123858832. PMC 3605887. PMID 22482452.
- ^ Gagliardi S, Cova E, Davin A, Guareschi S, Abel K, Alvisi E, Laforenza U, Gidoni R, Cashman JR, Ceroni M, Cereda C (avgust 2010). "Sporodik amiotrofik lateral sklerozda SOD1 mRNA ekspressioni". Kasallikning neyrobiologiyasi. 39 (2): 198–203. doi:10.1016 / j.nbd.2010.04.008. PMID 20399857. S2CID 207065284.
- ^ Kikuchi H, Furuta A, Nishioka K, Suzuki SO, Nakabeppu Y, Ivaki T (aprel 2002). "Amitrofik lateral sklerozning orqa miya motor neyronlarida 8-okso-guanin to'planishiga qarshi mitoxondriyal DNKni tiklash fermentlarining buzilishi". Acta Neuropathol. 103 (4): 408–14. doi:10.1007 / s00401-001-0480-x. PMID 11904761. S2CID 2102463.
- ^ Warita H, Hayashi T, Murakami T, Manabe Y, Abe K (aprel 2001). "Transgen ALS sichqonlarining o'murtqa motonuronlaridagi mitoxondriyal DNKning oksidlovchi zarari". Brain Res. Mol. Brain Res. 89 (1–2): 147–52. doi:10.1016 / S0169-328X (01) 00029-8. PMID 11311985.
- ^ Rozen DR, Bowling AC, Patterson D, Usdin TB, Sapp P, Mezey E, MakKenna-Yasek D, O'Regan J, Raxmani Z, Ferrante RJ (iyun 1994). "Tez-tez ala 4 dan val superoksid dismutaz-1 mutatsiyasi tez sur'atlarda rivojlanayotgan oilaviy amiotrofik lateral skleroz bilan bog'liq". Inson molekulyar genetikasi. 3 (6): 981–7. doi:10.1093 / hmg / 3.6.981. PMID 7951249.
- ^ Cudkowicz ME, McKenna-Yasek D, Sapp PE, Chin V, Geller B, Hayden DL, Schoenfeld DA, Hosler BA, Horvitz HR, Brown Brown (Fevral 1997). "Amiotrofik lateral sklerozda superoksid dismutaza mutatsiyalarining epidemiologiyasi". Nevrologiya yilnomalari. 41 (2): 210–21. doi:10.1002 / ana.410410212. PMID 9029070. S2CID 25595595.
- ^ a b Valentin JS, Xart PJ (aprel 2003). "Noto'g'ri CuZnSOD va amiotrofik lateral skleroz". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 100 (7): 3617–22. Bibcode:2003PNAS..100.3617V. doi:10.1073 / pnas.0730423100. PMC 152971. PMID 12655070.
- ^ Broom WJ, Jonson DV, Auwarter KE, Iafrate AJ, Russ C, Al-Chalabi A, Sapp PC, McKenna-Yasek D, Andersen PM, Brown RH (2008 yil yanvar). "SOD1A4V vositachiligidagi ALS: bir-biri bilan chambarchas bog'liq modifikator genining yo'qligi va Osiyoda kelib chiqishi". Nevrologiya xatlari. 430 (3): 241–5. doi:10.1016 / j.neulet.2007.11.004. PMID 18055113. S2CID 46282375.
- ^ a b v Myuller FL, Liu Y, Jernigan A, Borchelt D, Richardson A, Van Remmen H (sentyabr 2008). "MnSOD etishmovchiligi ALS mutantining ikki xil modelida kasallikning rivojlanishiga differentsial ta'sir ko'rsatadi". Mushak va asab. 38 (3): 1173–83. doi:10.1002 / mus.21049. PMID 18720509. S2CID 23971601.
- ^ Bergemalm D, Jonsson, PA, Graffmo KS, Andersen PM, Brännström T, Rehnmark A, Marklund SL (2006 yil aprel). "Murin amyotrofik lateral skleroz modellarining mitoxondriyalarida insonning beqaror superoksid dismutaz-1 variantlarining haddan tashqari yuklanishi". Neuroscience jurnali. 26 (16): 4147–54. doi:10.1523 / JNEUROSCI.5461-05.2006. PMC 6673995. PMID 16624935.
- ^ Pan L, Yoshii Y, Otomo A, Ogawa H, Ivasaki Y, Shang HF, Hadano S (2012). "SOD1G93A va SOD1H46R turli xil odamlarning mis-sink superoksid dismutaz mutantlari, sichqonlarda yalpi fenotipga aniq zararli ta'sir ko'rsatadi". PLOS ONE. 7 (3): e33409. Bibcode:2012PLoSO ... 733409P. doi:10.1371 / journal.pone.0033409. PMC 3306410. PMID 22438926.
- ^ Battacharya A, Bokov A, Myuller FL, Jernigan AL, Maslin K, Diaz V, Richardson A, Van Remmen H (avgust 2012). "Ratsionni cheklash, ammo rapamitsin emas, kasallikning boshlanishi va ALS ning H46R / H48Q sichqoncha modelini saqlab qolishini kengaytiradi". Qarishning neyrobiologiyasi. 33 (8): 1829–32. doi:10.1016 / j.neurobiolaging.2011.06.002. PMID 21763036. S2CID 11227242.
- ^ Vargas MR, Jonson DA, Jonson JA (sentyabr 2011). "Glyutationning kamayishi oilaviy ALS bilan bog'langan hSOD1 (G93A) sichqon modelida nevrologik defitsit va mitoxondriyal patologiyani tezlashtiradi". Kasallikning neyrobiologiyasi. 43 (3): 543–51. doi:10.1016 / j.nbd.2011.04.025. PMC 3139005. PMID 21600285.
- ^ Komatsu T, Duckyoung Y, Ito A, Kurosawa K, Maehata Y, Kubodera T, Ikeda M, Lee MC (sentyabr 2013). "Daun sindromi bilan kasallangan bemorlarning tupurigida oksidlovchi stress biomarkerlarining ko'payishi". Arch. Og'zaki biol. 58 (9): 1246–50. doi:10.1016 / j.archoralbio.2013.03.017. PMID 23714170.
- ^ Pallardó FV, Degan P, d'Ischia M, Kelly FJ, Zatterale A, Calzone R, Castello G, Fernandes-Delgado R, Dunster C, Lloret A, Manini P, Pisanti MA, Vuttariello E, Pagano G (avgust 2006). "Daun sindromi bilan kasallangan bemorlarning erta yoshdagi proksidant holatiga oid ko'plab dalillar". Biogerontologiya. 7 (4): 211–20. doi:10.1007 / s10522-006-9002-5. PMID 16612664. S2CID 13657691.
- ^ Casareno RL, Wagoner D, Gitlin JD (sentyabr 1998). "Mis chaperone CCS to'g'ridan-to'g'ri mis / sink superoksid dismutaz bilan o'zaro ta'sir qiladi". Biologik kimyo jurnali. 273 (37): 23625–8. doi:10.1074 / jbc.273.37.23625. PMID 9726962.
- ^ Pasinelli P, Belford ME, Lennon N, Bacskai BJ, Hyman BT, Trotti D, Brown Brown (iyul 2004). "Amiotrofik lateral skleroz bilan bog'liq bo'lgan SOD1 mutant oqsillari umurtqa pog'onasi mitoxondriyasida Bcl-2 bilan bog'lanib, birlashadi". Neyron. 43 (1): 19–30. doi:10.1016 / j.neuron.2004.06.021. PMID 15233914. S2CID 18141051.
- ^ Cova E, Giroldi A, Guareschi S, Mazzini G, Gagliardi S, Davin A, Bianchi M, Ceroni M, Cereda C (oktyabr 2010). "G93A SOD1 amiotrofik lateral sklerozning uyali modelida hujayra tsiklini o'zgartiradi". Uyali signalizatsiya. 22 (10): 1477–84. doi:10.1016 / j.cellsig.2010.05.016. PMID 20561900.
- ^ Cereda C, Cova E, Di Poto C, Galli A, Mazzini G, Corato M, Ceroni M (2006 yil noyabr). "Azot oksidining sporadik amiotrofik lateral sklerozli bemorlarning limfotsitlariga ta'siri: toksikmi yoki himoya o'rni?". Nevrologiya fanlari. 27 (5): 312–6. doi:10.1007 / s10072-006-0702-z. PMID 17122939. S2CID 25059353.
- ^ Cova E, Cereda C, Galli A, Curti D, Finotti C, Di Poto C, Corato M, Mazzini G, Ceroni M (may 2006). "BSl-2 va SOD1 oqsillarini limfotsitlarda sporadik ALS kasallaridan ekspluatatsiya qilingan ekspluatatsiyasi". Nevrologiya xatlari. 399 (3): 186–90. doi:10.1016 / j.neulet.2006.01.057. PMID 16495003. S2CID 26076370.
Qo'shimcha o'qish
- de Belleroche J, Orrell R, King A (1995 yil noyabr). "Oilaviy amiotrofik lateral skleroz / motorli neyron kasalligi (FALS): dolzarb o'zgarishlarni ko'rib chiqish". Tibbiy genetika jurnali. 32 (11): 841–7. doi:10.1136 / jmg.32.11.841. PMC 1051731. PMID 8592323.
- Ceroni M, Curti D, Alimonti D (2002). "Amiotrofik lateral skleroz va SOD1 geni: umumiy nuqtai". Funktsional nevrologiya. 16 (4 ta qo'shimcha): 171-80. PMID 11996514.
- Zelko IN, Mariani TJ, Folz RJ (avgust 2002). "Superoksid dismutaz multigene oilasi: CuZn-SOD (SOD1), Mn-SOD (SOD2) va EC-SOD (SOD3) gen tuzilmalari, evolyutsiyasi va ekspressionini taqqoslash". Bepul radikal biologiya va tibbiyot. 33 (3): 337–49. doi:10.1016 / S0891-5849 (02) 00905-X. PMID 12126755.
- Hadano S (iyun 2002). "[Oilaviy amiotrofik lateral skleroz uchun sababchi genlar]". Seykakaku. Yaponiya biokimyoviy jamiyati jurnali. 74 (6): 483–9. PMID 12138710.
- Noor R, Mittal S, Iqbol J (sentyabr 2002). "Superoksid dismutaz - qo'llanilishi va inson kasalliklariga aloqadorligi". Tibbiyot fanlari monitori. 8 (9): RA210-5. PMID 12218958.
- Potter SZ, Valentin JS (2003 yil aprel). "Mis-sink superoksid dismutazaning amiotrofik lateral sklerozdagi ajablantiradigan roli (Lou Gehrig kasalligi)". Biologik anorganik kimyo jurnali. 8 (4): 373–80. doi:10.1007 / s00775-003-0447-6. PMID 12644909. S2CID 22820101.
- Rotilio G, Aquilano K, Ciriolo MR (2004). "Neyrodejenerativ jarayonlarda Cu, Zn superoksid dismutaza va azot oksidi sintazining o'zaro ta'siri". IUBMB hayoti. 55 (10–11): 629–34. doi:10.1080/15216540310001628717. PMID 14711010. S2CID 19518719.
- Jafari-Schluep HF, Khoris J, Mayeux-Portas V, Hand C, Rouleau G, Camu V (2004 yil yanvar). "[Oilaviy amyotrofik lateral sklerozda superoksid dismutaz 1 gen anomaliyalari: fenotip / genotip korrelyatsiyasi. Frantsuz tajribasi va adabiyotlarni ko'rib chiqish]". Revue Neurologique. 160 (1): 44–50. doi:10.1016 / S0035-3787 (04) 70846-2. PMID 14978393.
- Faraci FM, Didion SP (2004 yil avgust). "Qon tomirlarini himoya qilish: tomir devoridagi superoksid dismutaz izoformalari". Arterioskleroz, tromboz va qon tomir biologiyasi. 24 (8): 1367–73. doi:10.1161 / 01.ATV.0000133604.20182.cf. PMID 15166009.
- Gagliardi S, Ogliari P, Davin A, Corato M, Cova E, Abel K, Cashman JR, Ceroni M, Cereda C (Avgust 2011). "Flavin tarkibidagi monooksigenaza mRNK darajasi SOD1-mutant sichqonlaridagi miya sohalarida yuqori darajada tartibga solinadi". Neyrotoksikani o'rganish. 20 (2): 150–8. doi:10.1007 / s12640-010-9230-y. PMID 21082301. S2CID 21856030.
- Battistini S, Ricci C, Lotti EM, Benigni M, Gagliardi S, Zucco R, Bondavalli M, Marcello N, Ceroni M, Cereda C (iyun 2010). "SOD1 genida yangi ekson 4 mutatsiyasi (L106F) bo'lgan og'ir oilaviy ALS". Nevrologiya fanlari jurnali. 293 (1–2): 112–5. doi:10.1016 / j.jns.2010.03.009. PMID 20385392. S2CID 24895265.