Selen kislotasi - Selenous acid
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomlari Selen kislotasi Selenik (IV) kislota | |
| Boshqa ismlar Selen kislotasi | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.029.067 |
| KEGG | |
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| H2SeO3 | |
| Molyar massa | 128,97 g / mol |
| Tashqi ko'rinishi | oq gigroskopik kristallar |
| Zichlik | 3,0 g / sm3 |
| Erish nuqtasi | 70 ° C da parchalanadi |
| juda eriydi | |
| Eriydiganlik | ichida eriydi etanol |
| Kislota (p.)Ka) | 2.46, 7.3[2] |
| Birlashtiruvchi taglik | Gidrogenselenit |
| −45.4·10−6 sm3/ mol | |
| Farmakologiya | |
| |
| Vena ichiga yuborish | |
| Huquqiy holat |
|
| Tegishli birikmalar | |
Boshqalar anionlar | selen kislotasi vodorod selenidi |
Boshqalar kationlar | natriy selenit |
Tegishli birikmalar | oltingugurt kislotasi tellur kislotasi polon kislotasi |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
| Klinik ma'lumotlar | |
|---|---|
| AHFS /Drugs.com | Monografiya |
| Litsenziya ma'lumotlari |
|
| Identifikatorlar | |
| DrugBank | |
| CompTox boshqaruv paneli (EPA) | |
| ECHA ma'lumot kartasi | 100.029.067 |
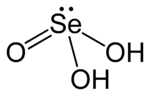
Selen kislotasi (yoki selen kislotasi) bo'ladi kimyoviy birikma bilan formula H2SeO3. Strukturaviy ravishda (HO) tomonidan aniqroq tavsiflangan2SeO. Bu asosiy okso kislotasi ning selen; boshqa mavjudot selen kislotasi.
Shakllanishi va xususiyatlari
Selen kislotasi shunga o'xshashdir oltingugurt kislotasi, lekin u osonroq ajratilgan. Selen kislotasi osongina hosil bo'ladi selen dioksidi suvga. Kristalli qattiq moddalar sifatida birikmani quyidagicha ko'rish mumkin piramidal molekulalar vodorod aloqalari bilan o'zaro bog'langan. Qarorda bu a diprotik kislota:[3]
- H
2SeO
3 ⇌ H+
+ HSeO−
3 (p.)Ka = 2.62) - HSeO−
3 ⇌ H+
+ SeO2−
3 (p.)Ka = 8.32)
Tabiatda u o'rtacha darajada oksidlanadi, ammo kinetik jihatdan sekin. 1 M ichida H+
:
- H
2SeO
3 + 4 H+
+ 4 e− ⇌ Se + 3H
2O (Eo= +0,74 V)
1 M ichida OH−
:
- SeO2−
3 + 4 e− + 3 H
2O ⇌ Se + 6OH−
(Eo= -0,37 V)
Selen kislotasi gigroskopik.[4][5]
Foydalanadi
Asosiy foydalanish po'latni himoya qilish va rangini o'zgartirish, ayniqsa qurol qurolidagi po'lat qismlar.[6] Deb nomlangan sovuq-ko'k jarayonida selen kislotasi ishlatiladi, mis (II) nitrat va azot kislotasi po'latning rangini kumush kulrangdan ko'k kulrang yoki qora rangga o'zgartirish. Muqobil protseduralardan foydalanish mis sulfat va fosfor kislotasi o'rniga. Ushbu jarayon qatlamning qatlamini yotqizadi mis selenid va hosil bo'ladigan boshqa blyuzing jarayonlaridan tubdan farq qiladi qora temir oksidi. Ba'zi eski tıraş pichoqlari ham ko'kargan po'latdan qilingan.[6]
Selenli kislota uchun yana bir foydalanish kimyoviy qorayish va patinatsiya mis, guruch va bronzadan iborat bo'lib, quyuq jigarrang rang hosil qiladi va uni mexanik aşınma bilan yanada yaxshilaydi.[iqtibos kerak ]
Bu ishlatiladi organik sintez sintezi uchun oksidlovchi vosita sifatida 1,2-dikarbonil birikmalar, masalan. laboratoriya tayyorlashda glyoksal (etan-1,2-dion) dan asetaldegid.[7]
Selenli kislota uning asosiy tarkibiy qismidir Mecke reaktivi giyohvand moddalarni tekshirish uchun ishlatiladi.[8]
Tibbiy
Selen kislotasi iz elementidir ko'rsatilgan odamlarda selen manbai sifatida.[9][10]
Sog'likka ta'siri
Ko'pgina selenli birikmalar singari, selenli kislota haddan tashqari ko'p miqdorda toksik bo'lib, har qanday miqdordagi selenli kislotani yutish odatda o'limga olib keladi, ammo u kerakli miqdordagi tasdiqlangan parhez manbai hisoblanadi. Belgilari selen zaharlanishi ta'siridan bir necha soat o'tgach sodir bo'lishi mumkin va o'z ichiga olishi mumkin ahmoqlik, ko'ngil aynish, og'ir gipotenziya va o'lim.[11]
Adabiyotlar
- ^ Lide, Devid R. (1998). Kimyo va fizika bo'yicha qo'llanma (87 tahr.). Boka Raton, Florida: CRC Press. 4-81 betlar. ISBN 0-8493-0594-2.
- ^ Ka va pKa Polyprotik kislotalar uchun. ucdsb.on.ca
- ^ Xolman, A. F.; Wiberg, E. "Anorganik kimyo" Akademik matbuot: San-Diego, 2001 y. ISBN 0-12-352651-5.
- ^ Lide, D.R. (tahrir). CRC Kimyo va fizika bo'yicha qo'llanma. 76-nashr Boka Raton, FL: CRC Press Inc., 1995-1996., P. 4-82
- ^ PubChem. "Selenli kislota". pubchem.ncbi.nlm.nih.gov. Olingan 2020-01-17.
- ^ a b Skarlato, E.A .; Higa, J. (1990 yil 28-iyun). "SELENIUM (PIM483)". Olingan 29 dekabr 2010.
- ^ "Glyoksal bisulfit", Organik sintezlar, To'plangan 3-jild, 438-bet (1955).
- ^ "Giyohvand moddalarni oldindan aniqlash uchun rangli sinov reagentlari to'plamlari" (PDF). Milliy adliya instituti. 2000-07-01. Olingan 2012-01-26.
- ^ "Selenli kislota in'ektsiyasi, eritma". DailyMed. 1 may 2020 yil. Olingan 22 oktyabr 2020.
- ^ "Giyohvand moddalarni tasdiqlash to'plami: Selenli kislota qarshi vositasi". BIZ. Oziq-ovqat va dori-darmonlarni boshqarish (FDA). Olingan 22 oktyabr 2020.
- ^ "Materiallarning xavfsizligi to'g'risida ma'lumot varag'i - Mahsulot nomi: maxsus opiat uchun reagent" (PDF). Sirchie Finger Print Laboratories, Inc. 2006 yil 12-may. Arxivlangan asl nusxasi (PDF) 2006 yil 18 oktyabrda.
Tashqi havolalar
- "Selenli kislota". Giyohvand moddalar haqida ma'lumot portali. AQSh milliy tibbiyot kutubxonasi.
