Kaspaz 1 - Caspase 1 - Wikipedia

Kaspaz-1/ Interleykin-1 konvertor fermenti (ICE) evolyutsion ravishda saqlanib qolgan ferment bu proteolitik kabi boshqa oqsillarni ajratadi kashshoflar yallig'lanish sitokinlar interleykin 1β va interleykin 18 shuningdek piroptoz induktor Gasdermin D. faol etuk peptidlarga.[5][6][7] Yallig'lanishga qarshi javob tashabbusi sifatida hujayra immunitetida markaziy rol o'ynaydi. Bir marta hosil bo'lishi orqali faollashtiriladi yallig'lanish murakkab, bu parchalanish orqali proinflamatuar javobni boshlaydi va shu bilan ikkita yallig'lanishni faollashtiradi sitokinlar, interleykin 1β (IL-1β) va interleykin 18 (IL-18), shuningdek piroptoz, dasturlashtirilgan litik hujayralar o'limi Kasderaz-1 tomonidan faollashtirilgan ikkita yallig'lanish sitokinlari qo'shni hujayralardagi yallig'lanish reaktsiyasini yanada kuchaytirish uchun hujayradan ajralib chiqadi.[8]
Uyali aloqa
Caspase-1 ko'pchilikda evolyutsion ravishda saqlanib qolgan eukaryotlar ning Qirollik Animalia. Yallig'lanishga qarshi immunitet reaktsiyasidagi roli tufayli u kabi immunitet organlarida yuqori darajada namoyon bo'ladi jigar, buyrak, taloq va qon (neytrofillar ).[9][10] INFEKTSION so'ng, yallig'lanish reaktsiyasi Caspase-1 ekspressionini oshiradi, a ijobiy fikr javobni kuchaytiradigan mexanizm.[10]
Tuzilishi
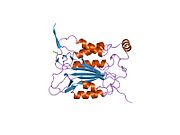
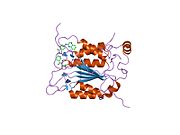
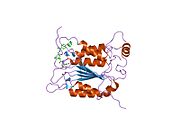
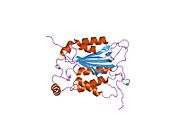
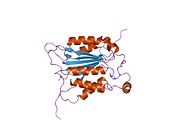
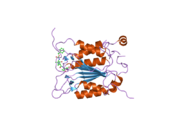
Caspase-1 a sifatida ishlab chiqariladi zimogen keyinchalik faol ferment tarkibiga kiradigan 20 kDa (p20) va 10 kDa (p10) bo'linmalariga bo'linishi mumkin. Active Caspase 1 ikkitasini o'z ichiga oladi heterodimerlar p20 va p10. U tarkibida p20 va p10 subbirliklarini qamrab oladigan faol saytga ega bo'lgan katalitik domen mavjud,[11] shuningdek, katalitik bo'lmagan Caspase-ni faollashtirish va ishga qabul qilish domeni (KARTA ). U boshqalar bilan o'zaro ta'sir qiladi KARTA tarkibida KART mavjud bo'lgan apoptoz bilan bog'liq chaykaga o'xshash oqsil kabi oqsillar (ASC ) va Nod kabi retseptorlari (NLR ) Oila CARD domen tarkibidagi oqsil 4 (NLRC4 ) inflammasomalarni shakllantirishda CARD-CARD o'zaro ta'sirlari orqali.[7][12]
Tartibga solish


Faollashtirish

Caspase-1, odatda fiziologik jihatdan faol bo'lmagan zimogen shaklida, ipga biriktirilganda avtomatik faollashadi. yallig'lanish p10 va p20 subbirliklariga avtoproteoliz orqali murakkab.[13][14] Inflammasom majmuasi bu signalga xos sensor oqsilining trimerlaridan tashkil topgan halqa majmuasi NLR oilasi va AIM-1 (Melanomada yo'q) retseptorlari, ASC kabi adapter oqsili va kaspaza kabi, bu holda Caspase-1. Ba'zi hollarda signal beruvchi oqsillar o'zlarining KARTalarini o'z ichiga olgan joylarda, masalan NLRP1 va NLRC4, CARD-CARDning o'zaro ta'siri to'g'ridan-to'g'ri, ya'ni kompleksda adapter oqsili yo'q. Sensor va adapterning turli xil oqsillari mavjud, ularning har xil birikmalari inflammasomalarning o'ziga xos signallarga ta'sirini ta'minlaydi. Bu hujayraning qabul qilingan xavf signalining zo'ravonligiga qarab har xil darajadagi yallig'lanish reaktsiyalariga ega bo'lishiga imkon beradi.[15][16]
Inhibisyon
Faqatgina CARD oqsillari (COPs) nomi bilan aytganda, faqat katalitik bo'lmagan KARTlarni o'z ichiga olgan oqsillardir. Yallig'lanish shakllanishida CARD-CARD o'zaro ta'sirining ahamiyati tufayli ko'plab COPlar Caspase faollashuvining taniqli inhibitori hisoblanadi. Caspase-1 uchun o'ziga xos COP-larning genlari - ICEBERG, COP1 (ICE / Pseudo-ICE) va INCA (Inhibitory Card) - ularning barchasi uning joylashgan joyi yaqinida topilgan va shuning uchun genlarni ko'paytirish hodisalari va keyinchalik ularni yo'q qilish natijasida paydo bo'lgan deb o'ylashadi. katalitik domenlar. Garchi ularning hammasi CARD-CARD o'zaro ta'siridan foydalangan holda inflammasomalar bilan o'zaro aloqada bo'lishsa-da, ular inhibitiv funktsiyalarni bajarish uslubi va shu bilan birga samaradorligi bilan farq qiladi.[14][17][18]
Masalan, ICEBERG Caspase-1 paychalarining hosil bo'lishini nukleatsiya qiladi va shu bilan filamentlarga qo'shiladi, ammo inflammasomalarning faollashishini inhibe qilish qobiliyatiga ega emas. Buning o'rniga, Caspase-1 ning boshqa muhim CARD oqsillari bilan o'zaro ta'siriga xalaqit berib, Caspase-1 aktivatsiyasini inhibe qiladi deb o'ylashadi.[14][17][18]
Boshqa tomondan, INCA, Caspase-1 CARD-ni yopib, yallig'lanishni to'g'ridan-to'g'ri bloklaydi oligomerlar Shunday qilib, keyingi polimerizatsiyani yallig'lanishli iplarga to'sib qo'yadi.[17][18][19][12]
Xuddi shunday, ba'zi bir POPlar (faqat pirin oqsillari), shuningdek, yallig'lanish mexanizmlarini shakllantirishda rol o'ynaydigan PYD o'zaro ta'sirini bog'lash va blokirovka qilish orqali inflammasom aktivatsiyasini inhibe qilish orqali Caspase-1 aktivatsiyasini tartibga solishi ma'lum. yaxshi tashkil etilgan.[18][20]
- Inhibitorlar
- Belnakasan (VX-765) [21]
- Pralnakasan (VX-740) [22]
Funktsiya
Proteolitik dekolte
Aktivlashtirilgan Caspase 1 proteolitik ravishda pro IL-1β va pro IL-18 ni o'zlarining faol shakllariga, IL-1β va IL-18 ga ajratadi. Faol sitokinlar quyi oqimdagi yallig'lanish reaktsiyasiga olib keladi. Shuningdek, u Gasdermin D ni faol shaklga ajratadi, bu esa piroptozga olib keladi.[12]
Yallig'lanish reaktsiyasi
Pishib bo'lgandan so'ng, sitokinlar a ni induktsiya qilish uchun quyi oqim signalizatsiya hodisalarini boshlashadi proinflamatuar javobini, shuningdek ifodasini faollashtirish uchun virusga qarshi genlar. Javobning tezligi, o'ziga xosligi va turlari qabul qilingan signalga, shuningdek uni qabul qilgan sensor oqsiliga bog'liq. Inflammasomalar tomonidan qabul qilinishi mumkin bo'lgan signallarga quyidagilar kiradi virusli ikki zanjirli RNK, karbamid, erkin radikallar va uyali xavf bilan bog'liq bo'lgan boshqa signallar, hatto boshqa immunitetga javob berish yo'llarining yon mahsulotlari.[23]
Etuk sitokinlarning o'zida kerakli tartiblash tartiblari mavjud emas ER-Golgi sekretor yo'li va shu bilan hujayradan an'anaviy usullar bilan chiqarilmaydi. Biroq, bularning chiqarilishi nazariy jihatdan proinflamatuar sitokinlar orqali uyali yorilishga bog'liq emas piroptoz, va aslida, bu faol jarayon. Ushbu faraz uchun ham, unga qarshi ham dalillar mavjud. Ko'pgina hujayra turlari uchun sitokinlarning piroptoz belgilari yo'qligiga qaramay ajralib chiqishi, bu farazni tasdiqlaydi.[16][24] Ammo ba'zi bir tajribalar shuni ko'rsatadiki, Gasdermin D funktsional bo'lmagan mutantlar hali ham sitokinlarning normal parchalanishiga ega edi, ammo ularni ajratish qobiliyatiga ega emas edi, bu aslida sekretsiya uchun piroptoz zarur bo'lganligini ko'rsatmoqda.[25]
Piroptozga qarshi javob
Yallig'lanish reaktsiyasidan so'ng, faollashtirilgan Caspase-1 qabul qilingan signalga va uni qabul qilgan o'ziga xos inflammasom sensori domen oqsiliga qarab, hujayralar o'limining litik shakli bo'lgan piroptozni keltirib chiqarishi mumkin. To'liq yallig'lanish reaktsiyasi uchun piroptoz kerak bo'lishi mumkin yoki kerak emasligiga qaramay, piroptoz paydo bo'lishidan oldin yallig'lanish reaktsiyasi to'liq talab qilinadi.[16] Piroptozni qo'zg'atish uchun Caspase-1 to'g'ridan-to'g'ri yoki ba'zi bir signal kaskadlari orqali piroptozga olib keladigan Gasdermin D ni ajratib turadi, aniq mexanizmi ma'lum emas.[16]
Boshqa rollar
Caspase-1 ning induktsiyalashi ham ko'rsatilgan nekroz va turli xil rivojlanish bosqichlarida ham ishlashi mumkin. Sichqonlarda shunga o'xshash oqsilni o'rganish patogenezida muhim rol o'ynaydi Xantington kasalligi. Shu bilan bir qatorda qo'shilish genning natijalari natijasida aniq izoformlarni kodlovchi beshta transkript variantlari mavjud.[26] So'nggi tadqiqotlar kaspaz-1ni CD4 T-hujayralari o'limini va OIV-ning yallig'lanishini rag'batlantirishga, shu bilan birga OITV kasalligining OITSga aylanishiga turtki bo'lgan ikkita imzoga sabab bo'ldi.[27][28] Caspase-1 faolligi, shuningdek, bakteriyalarning fagotsitozidan keyin lizozomalarning kislotalashuviga ta'sir ko'rsatdi[29] va immunitet komplekslari.[30]
Shuningdek qarang
Adabiyotlar
- ^ a b v GRCh38: Ensembl relizi 89: ENSG00000137752 - Ansambl, 2017 yil may
- ^ a b v GRCm38: Ensembl relizi 89: ENSMUSG00000025888 - Ansambl, 2017 yil may
- ^ "Human PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ "Sichqoncha PubMed ma'lumotnomasi:". Milliy Biotexnologiya Axborot Markazi, AQSh Milliy Tibbiyot Kutubxonasi.
- ^ Thornberry NA, Bull HG, Calaycay JR, Chapman KT, Howard AD, Kostura MJ, Miller DK, Molineaux SM, Weidner JR, Aunins J (aprel 1992). "Monotsitlarda interleykin-1 beta-ishlov berish uchun yangi heterodimerik sistein proteaz talab qilinadi". Tabiat. 356 (6372): 768–74. doi:10.1038 / 356768a0. PMID 1574116. S2CID 4310923.
- ^ Cerretti DP, Kozlosky CJ, Mosley B, Nelson N, Van Ness K, Greenstreet TA, March CJ, Kronheim SR, Druck T, Cannizzaro LA (aprel 1992). "Interlökin-1 beta-konvertor fermentining molekulyar klonlashi". Ilm-fan. 256 (5053): 97–100. doi:10.1126 / science.1373520. PMID 1373520.
- ^ a b Mariathasan S, Nyuton K, Monak DM, Vucic D, Frantsuz DM, Li WP, Roose-Girma M, Erickson S, Dixit VM (iyul 2004). "Asp va Ipaf kaspaz-1 adapterlari bilan inflamatomani differentsial faollashtirish". Tabiat. 430 (6996): 213–8. doi:10.1038 / tabiat02664. PMID 15190255. S2CID 4317409.
- ^ Yorgensen I, Miao EA (may, 2015). "Pyroptotik hujayralar o'limi hujayra ichidagi patogenlardan himoya qiladi". Immunologik sharhlar. 265 (1): 130–42. doi:10.1111 / imr.12287. PMC 4400865. PMID 25879289.
- ^ Bakele M, Joos M, Burdi S, Allgaier N, Pöschel S, Fehrenbacher B, Schaller M, Marcos V, Kümmerle-Deschner J, Rieber N, Borregaard N, Yazdi A, Hector A, Hartl D (Fevral 2014). "Neytrofillardagi inflammasomaning lokalizatsiyasi va funktsionalligi". Biologik kimyo jurnali. 289 (8): 5320–9. doi:10.1074 / jbc.M113.505636. PMC 3931087. PMID 24398679.
- ^ a b Kumaresan V, Ravichandran G, Nizam F, Dhayanithi NB, Arasu MV, Al-Dabi NA, Harikrishnan R, Arockiaraj J (fevral 2016). "Ko'p funktsional murrel kaspaz 1, 2, 3, 8 va 9: konservatsiya, o'ziga xoslik va ularning patogen ta'sirida ekspresiya uslubi". Baliqlar va qisqichbaqasimonlar immunologiyasi. 49: 493–504. doi:10.1016 / j.fsi.2016.01.008. PMID 26777895.
- ^ Wilson KP, Black JA, Tomson JA, Kim EE, Griffit JP, Navia MA, Murcko MA, Chambers SP, Aldape RA, Raybuck SA (iyul 1994). "Interlökin-1 beta-konvertor fermentining tuzilishi va mexanizmi". Tabiat. 370 (6487): 270–5. doi:10.1038 / 370270a0. PMID 8035875. S2CID 4281700.
- ^ a b v Lu A, Li Y, Shmidt FI, Yin Q, Chen S, Fu TM, Tong AB, Ploeg HL, Mao Y, Vu H (may 2016). "Kaspaza-1 polimerizatsiyasining molekulyar asoslari va uni yangi yopilish mexanizmi bilan inhibe qilish". Tabiatning strukturaviy va molekulyar biologiyasi. 23 (5): 416–25. doi:10.1038 / nsmb.3199. PMC 4856535. PMID 27043298.
- ^ Elliott JM, Rouge L, Wiesmann C, Scheer JM (mart 2009). "Prokaspaza-1 zimogen domenining kristalli tuzilishi yallig'lanishli kaspaza otoaktivatsiyasi to'g'risida tushunchani ochib beradi". Biologik kimyo jurnali. 284 (10): 6546–53. doi:10.1074 / jbc.M806121200. PMC 2649088. PMID 19117953.
- ^ a b v Humke EW, Shriver SK, Starovasnik MA, Fairbrother WJ, Dixit VM (2000). "ICEBERG: interleykin-1beta avlodining yangi inhibitori". Hujayra. 103 (1): 99–111. doi:10.1016 / S0092-8674 (00) 00108-2. PMID 11051551. S2CID 15886378.
- ^ Samarani S, Allam O, Sagala P, Aldabah Z, Jenabian MA, Mehraj V, Tremblay C, Routy JP, Amre D, Ahmad A (iyun 2016). "Il-18 ning muvozanatsiz ishlab chiqarilishi va inson kasalliklarida uning antagonisti va uning OIV-1 infektsiyasiga ta'siri". Sitokin. Yallig'lanish, qarish, saraton va semirishda sitokinlar. 82: 38–51. doi:10.1016 / j.cyto.2016.01.006. PMID 26898120.
- ^ a b v d Vince JE, Silke J (2016). "Hujayra o'limi va inflammasoma faollashuvi chorrahasi". Uyali va molekulyar hayot haqidagi fanlar. 73 (11–12): 2349–67. doi:10.1007 / s00018-016-2205-2. PMID 27066895. S2CID 16281016.
- ^ a b v Druilhe A, Srinivasula SM, Razmara M, Ahmad M, Alnemri ES (iyun 2001). "Pseudo-ICE va ICEBERG tomonidan IL-1beta hosil bo'lishini tartibga solish, ikkita dominant salbiy kaspazni ishga qabul qilish domen oqsillari". Hujayra o'limi va differentsiatsiyasi. 8 (6): 649–57. doi:10.1038 / sj.cdd.4400881. PMID 11536016.
- ^ a b v d Le HT, Xarton JA (2013-01-01). "NLR funktsiyalarining regulyatori sifatida faqat pirinli va CARD oqsillari". Immunologiya chegaralari. 4: 275. doi:10.3389 / fimmu.2013.00275. PMC 3775265. PMID 24062743.
- ^ Lamkanfi M, Denecker G, Kalai M, D'hondt K, Meeus A, Declercq V, Saelens X, Vandenabeele P (dekabr 2004). "INCA, interlökin-1beta avlodini inhibe qiluvchi yangi inson kaspazasi bilan ishlaydigan domen oqsillari". Biologik kimyo jurnali. 279 (50): 51729–38. doi:10.1074 / jbc.M407891200. PMID 15383541.
- ^ Dorfleutner A, Talbott SJ, Bryan NB, Funya KN, Rellick SL, Reed JC, Shi X, Rojanasakul Y, Flynn DC, Stehlik C (dekabr 2007). "Shope Fibroma virusi bo'lgan, faqat PYRIN oqsili xostning immun javobini modulyatsiya qiladi". Virus genlari. 35 (3): 685–94. doi:10.1007 / s11262-007-0141-9. PMC 4257706. PMID 17676277.
- ^ Flores J, Noël A, Foveau B, Lynham J, Lecrux C, LeBlanc AC (sentyabr 2018). "Caspase-1 inhibisyoni Altsgeymer kasalligi sichqon modelidagi kognitiv buzilish va neyropatologiyani engillashtiradi". Nat Commun. 9 (1): 3916. doi:10.1038 / s41467-018-06449-x. PMC 6156230. PMID 30254377.
- ^ Bokschi MB, Quinn AM, Shen M, Jadxav A, Leister V, Simeonov A, Auld DS, Tomas CJ (may, 2010). "3 ta siyanopropanoik kislota qismidan foydalanadigan juda kuchli va selektiv kaspaza 1 inhibitori". ChemMedChem. 5 (5): 730–8. doi:10.1002 / cmdc.200900531. PMC 3062473. PMID 20229566.
- ^ Vezzani A, Maroso M, Balosso S, Sanches MA, Bartfai T (oktyabr 2011). "IL-1 retseptorlari / infektsiyani, yallig'lanishni, stressni va neyrodejeneratsiyani ko'rsatadigan tolga o'xshash retseptorlari signallari juftlarning gipereksitilligi va tutilishi". Miya, o'zini tutish va immunitet. 25 (7): 1281–9. doi:10.1016 / j.bbi.2011.03.018. PMID 21473909. S2CID 3383795.
- ^ Ainscough JS, Gerberick GF, Kimber I, Dearman RJ (dekabr 2015). "Interleykin-1βni qayta ishlash kalmodulin bilan kaltsiy vositachiligiga bog'liq". Biologik kimyo jurnali. 290 (52): 31151–61. doi:10.1074 / jbc.M115.680694. PMC 4692238. PMID 26559977.
- ^ U WT, Van H, Xu L, Chen P, Vang X, Xuang Z, Yang ZH, Zhong CQ, Xan J (dekabr 2015). "Gasdermin D - pyroptozning bajaruvchisi va interleykin-1β sekretsiyasi uchun zarur". Hujayra tadqiqotlari. 25 (12): 1285–98. doi:10.1038 / cr.2015.139. PMC 4670995. PMID 26611636.
- ^ "Entrez Gen: CASP1 kaspaz 1, apoptozga bog'liq sistein peptidaza (interleykin 1, beta, konvertaza)".
- ^ Doitsh G, Galloway NL, Geng X, Yang Z, Monro KM, Zepeda O, Hunt PW, Hatano H, Sowinski S, Muñoz-Arias I, Greene WC (yanvar 2014). "Piroptoz tufayli hujayraning o'lishi OIV-1 infektsiyasida CD4 T-hujayrasining kamayishiga olib keladi". Tabiat. 505 (7484): 509–14. doi:10.1038 / tabiat12940. PMC 4047036. PMID 24356306.
- ^ Monro KM, Yang Z, Jonson JR, Geng X, Doytsh G, Krogan NJ, Grin WC (yanvar 2014). "IFI16 DNK sensori OIV bilan abortli ravishda yuqtirilgan limfoid CD4 T hujayralarining o'limi uchun talab qilinadi". Ilm-fan. 343 (6169): 428–32. doi:10.1126 / science.1243640. PMC 3976200. PMID 24356113.
- ^ Sokolovska A, Becker CE, Ip WK, Rathinam VA, Brudner M, Paket N, Tanne A, Vanaja SK, Mur KJ, Fitzgerald KA, Leysi-Xulbert A, Styuart LM (iyun 2013). "Kasplaz-1ni NLRP3 inflammasomasi bilan faollashishi fagosoma funktsiyasini boshqarish uchun NADPH oksidaz NOX2 ni tartibga soladi". Tabiat immunologiyasi. 14 (6): 543–53. doi:10.1038 / ni.2955. PMC 3708594. PMID 23644505.
- ^ Monteith AJ, Vinsent XA, Kang S, Li P, Klaibern TM, Rajfur Z, Jeykobson K, Moorman NJ, Vilen BJ (iyul 2018). "mTORC2 faolligi Rab39a ning kaspaz-1 parchalanishini buzganligi sababli tizimli eritupoz qizilo'ngachida lizozoma kislotaliligini buzadi". Immunologiya jurnali. 201 (2): 371–382. doi:10.4049 / jimmunol.1701712. PMC 6039264. PMID 29866702.