Muvofiqlashtirish majmuasi - Coordination complex
A muvofiqlashtirish kompleksi markazdan iborat atom yoki ion, odatda bu metall va deyiladi muvofiqlashtirish markaziva atrofidagi qator bog'langan molekulalar yoki ionlar, ular o'z navbatida sifatida tanilgan ligandlar yoki murakkablashtiruvchi vositalar.[1][2][3] Ko'p metall o'z ichiga oladi birikmalar, ayniqsa o'tish metallari, muvofiqlashtirish majmualari.[4] Markazi metall atomi bo'lgan koordinatsion kompleks d blok elementining metall kompleksi deyiladi.
Nomenklatura va terminologiya
Muvofiqlashtiruvchi komplekslar shunchalik keng tarqalganki, ularning tuzilmalari va reaktsiyalari ko'p jihatdan, ba'zida chalkashlik bilan tavsiflanadi. Ligandadagi atom markaziy metall atomi yoki ioniga bog'langan donor atomidir. Oddiy kompleksda metall ioni bir xil yoki har xil bo'lishi mumkin bo'lgan bir necha donor atomlari bilan bog'langan. A polidentat (ko'p bog'langan) ligand - bu markaziy atom bilan ligandning bir nechta atomlari orqali bog'lanib turadigan molekula yoki ion; markaziy atomga 2, 3, 4 yoki hatto 6 ta bog'lanishiga ega ligandlar keng tarqalgan. Ushbu komplekslar deyiladi xelat komplekslari; bunday komplekslarning vujudga kelishi xelatlanish, komplekslanish va koordinatsiya deyiladi.
Markaziy atom yoki ion barcha ligandlar bilan birgalikda quyidagilarni o'z ichiga oladi muvofiqlashtirish sohasi.[5][6] Markaziy atomlar yoki ion va donor atomlar birinchi koordinatsion sohani o'z ichiga oladi.
Muvofiqlashtirish "koordinatali kovalent bog'lanishlar" ga ishora qiladi (dipolyar aloqalar ) ligandlar va markaziy atom o'rtasida. Dastlab, kompleks qayta tiklanadigan assotsiatsiyani nazarda tutgan molekulalar, atomlar, yoki ionlari shunday kuchsizlar orqali kimyoviy aloqalar. Muvofiqlashtiruvchi kimyoga nisbatan ushbu ma'no rivojlandi. Ba'zi metall komplekslar deyarli qaytarilmas shaklda hosil bo'ladi va ko'plari bir-biriga juda kuchli bog'lanishlar bilan bog'lanadi.[7][8]
Markaziy atom yoki ionga biriktirilgan donor atomlarining soni deyiladi muvofiqlashtirish raqami. Eng keng tarqalgan koordinatsion sonlar 2, 4 va ayniqsa 6 ga teng. Gidratlangan ion bu murakkab ionning bir turi (yoki shunchaki kompleks), bu markaziy metall ioni va uning atrofidagi bir yoki bir nechta ligandlar, molekulalar yoki ionlar o'rtasida hosil bo'lgan tur. kamida bitta yolg'iz elektronni o'z ichiga oladi.
Agar barcha ligandlar bo'lsa monodentat, keyin donor atomlari soni ligandlar soniga teng. Masalan, kobalt (II) geksahidrat ioni yoki geksakaakobalt (II) ion [Co (H2O)6]2+ gidratlangan kompleks ion bo'lib, u metal ioniga biriktirilgan oltita suv molekulasidan iborat. Oksidlanish darajasi va koordinatsion raqami metall ioni bilan kompleks ionidagi ligandlar o'rtasida hosil bo'lgan bog'lanishlar sonini aks ettiradi. Biroq, Pt ning koordinatsion raqami (uz )2+
2 jami to'rt donor atomini o'z ichiga olgan ikkita bidentat ligandga ega bo'lgani uchun 4 (2 o'rniga).
Har qanday donor atom elektron juftligini beradi. Bir nechta juft elektronni taklif qila oladigan donor atomlari yoki guruhlari mavjud. Ular bidentat (ikki juft elektronni taklif qiladi) yoki polidentat (ikki juftdan ko'proq elektronni taklif qiladi) deb nomlanadi. Ba'zi hollarda atom yoki guruh elektronlarning juftligini ikkiga o'xshash yoki turli xil markaziy metall atomlariga yoki qabul qiluvchilarga elektronlar juftligini taklif qiladi. uch markazli ikki elektronli bog'lanish. Ular ko'prikli ligandlar deb ataladi.
Tarix
Muvofiqlashtiruvchi komplekslar zamonaviy kimyo boshlangandan beri ma'lum bo'lgan. Dastlabki taniqli koordinatsion komplekslar kabi bo'yoqlarni o'z ichiga oladi Prussiya ko'k. Ularning xususiyatlari birinchi marta 1800 yil ishidan so'ng 1800 yillarning oxirlarida yaxshi tushunilgan Christian Wilhelm Blomstrand. Blomstrand "deb nomlangan narsalarni ishlab chiqdi murakkab ion zanjiri nazariyasi. Nazariya koordinatsion komplekslarning paydo bo'lishining sababi shundaki, eritmada ionlar ammiak zanjiri orqali bog'lanib qoladi.[tushuntirish kerak ] U bu ta'sirni turli xil uglevod zanjirlari paydo bo'lishiga taqqosladi.
Ushbu nazariyani kuzatib, daniyalik olim Sofus Mads Yorgensen uni takomillashtirdi. Yorgensen nazariya versiyasida, molekula eritmada dissotsiatsiya qilinganida, natijada ikkita natija bo'lishi mumkin edi: ionlar Blomstrand ta'riflagan ammiak zanjiri orqali bog'lanadi yoki ionlar to'g'ridan-to'g'ri metallga bog'lanadi.
1893 yilga qadar nazariyaning bugungi kunda eng ko'p qabul qilingan versiyasi nashr etildi Alfred Verner. Vernerning ishi Blomstrand nazariyasiga ikkita muhim o'zgarishlarni kiritdi. Birinchisi, Verner ikki imkoniyatni muvofiqlashtirish sohasidagi joylashuvi nuqtai nazaridan ta'riflagan. Uning so'zlariga ko'ra, agar ionlar zanjir hosil qilsa, bu koordinatsiya doirasidan tashqarida bo'ladi, to'g'ridan-to'g'ri metallga bog'langan ionlar esa koordinatsion sohada bo'ladi.[9] Verner o'zining eng muhim kashfiyotlaridan birida zanjir nazariyasining aksariyatini rad etdi. Verner kompleks hexakoordinat kobaltining hosil bo'lishida ishtirok etgan ligandlarning fazoviy joylashishini kashf etdi. Uning nazariyasi muvofiqlashtirilgan ligand va birikmadagi zaryadlarni muvozanatlashtiruvchi ion o'rtasidagi farqni, masalan, kobaltammin xloridlaridagi xlor ionini tushunishga va ilgari tushuntirib bo'lmaydigan ko'plab izomerlarni tushuntirishga imkon beradi.
1911 yilda Verner birinchi navbatda koordinatsion kompleksni hal qildi geksol ichiga optik izomerlar, faqat uglerod birikmalariga ega bo'lishi mumkin bo'lgan nazariyani bekor qilish chirallik.[10]
Tuzilmalar
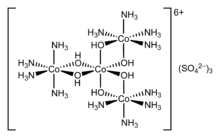
Markaziy atomni o'rab turgan ionlar yoki molekulalar deyiladi ligandlar. Ligandlar quyidagicha tasniflanadi L yoki X (yoki ularning kombinatsiyasi), ligand va markaziy atom o'rtasidagi bog'lanishni qancha elektron bilan ta'minlashiga bog'liq. L ligandlar a dan ikkita elektronni ta'minlaydi yolg'iz elektron juftlik, natijada a koordinatali kovalent boglanish. X ligandlar bitta elektronni, markaziy atom esa boshqa elektronni ta'minlaydi va shu bilan doimiy hosil qiladi kovalent boglanish. Ligandlar deyilgan muvofiqlashtirilgan atomga. Uchun alkenlar, pi obligatsiyalari metall atomlariga muvofiqlashtira oladi. Misol etilen majmuada [PtCl3(C2H4)]−.
Geometriya
Muvofiqlashtiruvchi kimyo tarkibida birinchi navbatda uning tuzilishi tasvirlanadi muvofiqlashtirish raqami, metallga biriktirilgan ligandlar soni (aniqrog'i, donor atomlarining soni). Odatda biriktirilgan ligandlarni hisoblash mumkin, lekin ba'zida hisoblash ham noaniq bo'lib qolishi mumkin. Muvofiqlashtiruvchi raqamlar odatda ikkitadan to'qqizgacha, lekin ko'p miqdordagi ligandlar lantanoidlar va aktinidlar uchun odatiy emas. Obligatsiyalar soni, hajmiga, to'loviga va elektron konfiguratsiyasi metal ioni va ligandlar. Metall ionlari bir nechta koordinatsion raqamga ega bo'lishi mumkin.
Odatda o'tish metall majmualari kimyosi s va p o'rtasidagi o'zaro ta'sirlarga ustunlik qiladi molekulyar orbitallar ligandlardagi donor-atomlar va metall ionlarining d orbitallari. Metallning s, p va d orbitallari 18 ta elektronni sig'dira oladi (qarang) 18-Elektron qoidasi ). Shunday qilib, ma'lum bir metall uchun maksimal koordinatsion raqam metall ionining elektron konfiguratsiyasi (aniqrog'i, bo'sh orbitallar soni) va ligandlar va metall ionlarining o'lchamlari bilan bog'liq. Katta metallar va kichik ligandlar yuqori koordinatsion sonlarga olib keladi, masalan. [Mo (CN)8]4−. Katta ligandli kichik metallar koordinatsion sonlarning past bo'lishiga olib keladi, masalan. Pt [P (CMe.)3)]2. Katta o'lchamlari tufayli, lantanoidlar, aktinidlar va erta o'tish metallari yuqori koordinatsion raqamlarga ega.
Aksariyat tuzilmalar sharlar ustidagi naqshga amal qilishadi (yoki, xuddi markaziy atom a ning o'rtasidadir ko'pburchak bu shaklning burchaklari ligandlarning joylashuvi), bu erda orbital qoplama (ligand va metall orbitallar orasidagi) va ligand-ligandning repulsiyalari ma'lum bir muntazam geometriyaga olib keladi. Eng ko'p kuzatiladigan geometriyalar quyida keltirilgan, ammo oddiy geometriyadan chetga chiqadigan holatlar ko'p, masalan. ligandlarning kattaligi tufayli yoki turli xil turdagi ligandlardan foydalanilganligi (bu bog'lanish uzunligining notekis bo'lishiga olib keladi; koordinatsion atomlar sharqa nuqtai nazariga amal qilmaydi). elektron effektlar (qarang, masalan, Jahn-Tellerning buzilishi ):
- Lineer ikki koordinatsiya uchun
- Uchburchak planar uch koordinatsiya uchun
- Tetraedral yoki kvadrat planar to'rtta muvofiqlashtirish uchun
- Trigonal bipiramidal besh koordinatsiya uchun
- Oktahedral oltita muvofiqlashtirish uchun
- Besh qirrali bipiramidal etti koordinatsiya uchun
- Kvadrat antiprizmatik sakkiz koordinatsiya uchun
- Uchburchak prizmatik to'qqiz koordinatsiya uchun
5-, 7-, 8- va 9- muvofiqlashtirishning idealizatsiyalangan tavsiflari ko'pincha bir-biridan biroz farq qiladigan L-M-L (ligand-metal-ligand) burchaklari bo'lgan alternativ tuzilmalardan geometrik jihatdan noaniqdir, masalan. kvadrat piramidal va trigonal bipiramidal tuzilmalar orasidagi farq.[11]
- Kvadrat piramidal besh koordinatsiya uchun[12]
- Qoplangan oktahedral yoki qopqoqli trigonal prizmatik etti koordinatsiya uchun[13]
- Dodecahedral yoki ikki tomonlama trigonal prizmatik sakkiz koordinatsiya uchun[14]
- Qopqoqli kvadrat antiprizmatik to'qqiz koordinatsiya uchun
Kam bo'lgan tizimlarda d elektronlar soni kabi maxsus elektron effektlar tufayli (ikkinchi darajali) Jahn-Teller barqarorlashtirish,[15] ba'zi geometriyalar (unda koordinatsion atomlar sharqa nuqtai nazariga amal qilmaydi) boshqa imkoniyatlarga nisbatan barqarorlashadi, masalan. ba'zi birikmalar uchun trigonal prizmatik geometriya oltita koordinatsiya uchun oktahedral tuzilmalarga nisbatan barqarorlashadi.
- Egilgan ikki koordinatsiya uchun
- Trigonal piramidal uch koordinatsiya uchun
- Trigonal prizmatik oltita muvofiqlashtirish uchun
Izomeriya
Ligandalarning joylashishi ma'lum bir kompleks uchun o'rnatiladi, ammo ba'zi hollarda u boshqa turg'unlikni hosil qiladigan reaktsiya bilan o'zgaruvchan bo'ladi izomer.
Ko'p turlari mavjud izomeriya koordinatsion komplekslarda, boshqa ko'plab birikmalarda bo'lgani kabi.
Stereoizomerizm
Stereoizomerizm aniq yo'nalishlarda bir xil bog'lanishlar bilan sodir bo'ladi. Stereoizomerizmni quyidagicha tasniflash mumkin:[16]
Sis-trans izomeriyasi va yuz-meridional izomeriyasi
Sis-trans izomeriyasi oktahedral va tarkibida uchraydi kvadrat planar komplekslar (lekin tetraedral emas). Ikki ligand qo'shni bo'lganda, ular deyiladi cis, bir-biriga qarama-qarshi bo'lganida, trans. Oktaedrning bitta yuzini uchta bir xil ligand egallaganida, izomer yuz yoki yuz. A yuz izomer, har qanday ikkita bir xil ligand qo'shni yoki cis bir-biriga. Agar bu uchta ligand va metall ioni bir tekislikda bo'lsa, izomer meridional, yoki deyiladi mer. A mer izomerni a ning birikmasi deb hisoblash mumkin trans va a cis, chunki u bir xil ligandlarning trans va cis juftlarini o'z ichiga oladi.

cis- [CoCl2(NH3)4]+

trans- [CoCl2(NH3)4]+

yuz- [CoCl3(NH3)3]

mer- [CoCl3(NH3)3]
Optik izomeriya
Optik izomeriya kompleks o'zining oynali tasviri bilan bir-biriga mos kelmaydigan holatlarda yuzaga keladi. Ikkala izomer har biri bo'lgani uchun shunday nomlangan optik jihatdan faol, ya'ni ular tekisligini aylantiradi qutblangan nur qarama-qarshi yo'nalishlarda. Ko'rsatilgan birinchi molekulada Λ (lambda ) uchta bidentat ligandlar tomonidan hosil qilingan chap pervanel burilishini tasvirlash uchun prefiks sifatida ishlatiladi. Ikkinchi molekula - birinchisining aksi bo'lib, uning belgisi Δ (delta ) o'ng pervanelni burish uchun prefiks sifatida. Uchinchi va to'rtinchi molekulalar o'xshash juft d va p izomerlari bo'lib, bu holda ikkita bidentat ligand va ikkita bir xil monodentat ligandlar mavjud.[17]

Δ- [Fe (ox)3]3−

Δ-cis- [CoCl2(uz)2]+
Strukturaviy izomeriya
Strukturaviy izomeriya bog'lanishlar o'zlari boshqacha bo'lganda paydo bo'ladi. Strukturaviy izomeriyaning to'rt turi tan olinadi: ionlanish izomeriyasi, solvat yoki gidrat izomeriyasi, bog'lanish izomeriyasi va koordinatsion izomeriya.
- Ionizatsiya izomeriyasi - izomerlar bir xil tarkibga ega bo'lishiga qaramay, eritmada har xil ionlarni beradi. Ushbu turdagi izomeriya kompleksning qarshi ioni ham potentsial ligand bo'lganda yuzaga keladi. Masalan, pentaamminebromokobalt (III) sulfat [Co (NH)3)5Br] SO4 qizil binafsha rangga ega va eritmada sulfat ioni borligini tasdiqlovchi bariy xlorid bilan cho'kma hosil bo'ladi, pentaamminesulphatecobalt (III) bromid [Co (NH)3)5SO4] Br qizil rangga ega va eritmadagi sulfat ioniga salbiy ta'sir ko'rsatadi, ammo uning o'rniga kumush nitrat bilan AgBr cho'kmasi hosil bo'ladi.[18]
- Solvat yoki gidrat izomeriyasi - izomerlari bir xil tarkibga ega, ammo ligand va shunchaki kristaldagi joylarni egallaydigan hal qiluvchi molekulalarining soni bo'yicha farqlanadi. Misollar: [Cr (H2O)6] Cl3 binafsha rangda, [CrCl (H.)2O)5] Cl2· H2O ko'k-yashil va [CrCl2(H2O)4] Cl · 2H2O to'q yashil rangda. Qarang kristallanish suvi.[18]
- Bog'lanish izomeriyasi bir nechta joyda bog'lab turishi mumkin bo'lgan muhitli ligandlar bilan sodir bo'ladi. Masalan, YO'Q2 ambientate ligand: U N atomida yoki O atomida metall bilan bog'lanishi mumkin.[19]
- Muvofiqlashtirish izomeriyasi - bu tuzning ham ijobiy, ham manfiy ionlari murakkab ionlar bo'lganida va ikki izomer ligandlarning kation va anion o'rtasida taqsimlanishida farq qilganda sodir bo'ladi. Masalan, [Co (NH.)3)6] [Cr (CN)6] va [Cr (NH3)6] [Co (CN)6].[18]
Elektron xususiyatlar
O'tish metall komplekslarining ko'plab xususiyatlari ularning elektron tuzilmalari tomonidan belgilanadi. Elektron strukturani metallarga va ligandlarga rasmiy zaryadlarni belgilaydigan nisbatan ionli model bilan tavsiflash mumkin. Ushbu yondashuv kristall maydon nazariyasi (CFT). Tomonidan kiritilgan kristalli maydon nazariyasi Xans Bethe 1929 yilda a beradi mexanik ravishda kvant komplekslarni tushunishga asoslangan urinish. Ammo kristall maydon nazariyasi kompleksdagi barcha o'zaro ta'sirlarni ionli deb hisoblaydi va ligandlarni salbiy nuqta zaryadlari bilan yaqinlashtirish mumkin deb taxmin qiladi.
Keyinchalik murakkab modellar kovalentlikni o'z ichiga oladi va ushbu yondashuv tasvirlangan ligand maydon nazariyasi (LFT) va Molekulyar orbital nazariya (MO). 1935 yilda kiritilgan va molekulyar orbital nazariyadan tashkil topgan Ligand maydon nazariyasi yanada kengroq komplekslarni boshqarishi va o'zaro ta'sirlar mavjud bo'lgan komplekslarni tushuntirishi mumkin. kovalent. Ning kimyoviy qo'llanilishi guruh nazariyasi rasmiy tenglamalarga sodda, simmetriya asosidagi echimlar berish orqali kristal yoki ligand maydon nazariyasini tushunishda yordam berishi mumkin.
Kimyogarlar qiziqish xususiyatlarini bashorat qilish uchun zarur bo'lgan eng oddiy modeldan foydalanishga moyildirlar; shu sababli, iloji bo'lsa, CFT munozaralar uchun favorit bo'lib kelgan. MO va LF nazariyalari ancha murakkab, ammo aniqroq istiqbolni ta'minlaydi.
Komplekslarning elektron konfiguratsiyasi ularga ba'zi muhim xususiyatlarni beradi:

O'tish metall komplekslarining rangi
O'tish metall majmualari ko'pincha yorug'likni yutish natijasida elektron o'tish natijasida yuzaga keladigan ajoyib ranglarga ega. Shu sababli ular ko'pincha sifatida qo'llaniladi pigmentlar. Rangli metall majmualari bilan bog'liq bo'lgan o'tishlarning aksariyati d-d o'tish yoki zaryad uzatish bantlari. D – d o'tish paytida metaldagi d orbitaldagi elektron foton tomonidan yuqori energiyaning boshqa d orbitaliga qo'zg'aladi, shuning uchun d –d o'tish faqat qisman to'ldirilgan d-orbital komplekslar (d) uchun sodir bo'ladi.1–9). D ga ega bo'lgan komplekslar uchun0 yoki d10 d-d o'tish imkoniyati bo'lmasa ham, zaryadni uzatish hali ham mumkin. Zaryad uzatish diapazoni elektronni metallga asoslangan orbitaldan bo'sh ligand asosidagi orbitalga aylantirishga olib keladi (zaryadni metalldan ligandga o'tkazish yoki MLCT). Bundan tashqari, teskari holat yuzaga keladi: ligand asosidagi orbitalda elektronni bo'sh metalga asoslangan orbitalga qo'zg'atish (liganddan metallga zaryad o'tkazish yoki LMCT). Ushbu hodisalarni elektron spektroskopiya yordamida kuzatish mumkin; shuningdek, nomi bilan tanilgan UV-Vis.[20] Simmetriyasi yuqori bo'lgan oddiy birikmalar uchun d –d o'tishlarni tayinlash mumkin Tanabe-Sugano diagrammalari. Ushbu topshiriqlar ko'proq qo'llab-quvvatlanmoqda hisoblash kimyosi.
| Fe2+ | Fe3+ | Co2+ | Cu2+ | Al3+ | Kr3+ | |
|---|---|---|---|---|---|---|
| Hidratlangan ion | [Fe (H2O)6]2+ Ochiq yashil Qaror | [Fe (H2O)6]3+ Sariq / jigarrang Qaror | [Co (H2O)6]2+ Pushti Qaror | [Cu (H2O)6]2+ Moviy Qaror | [Al (H2O)6]3+ Rangsiz Qaror | [Cr (H2O)6]3+ Yashil Qaror |
| (OH)−, suyultiriladi | [Fe (H2O)4(OH)2] To'q yashil Cho'kma | [Fe (H2O)3(OH)3] jigarrang Cho'kma | [Co (H2O)4(OH)2] Moviy / yashil Cho'kma | [Cu (H2O)4(OH)2] Moviy Cho'kma | [Al (H2O)3(OH)3] Oq Cho'kma | [Cr (H2O)3(OH)3] Yashil Cho'kma |
| (OH)−, jamlangan | [Fe (H2O)4(OH)2] To'q yashil Cho'kma | [Fe (H2O)3(OH)3] jigarrang Cho'kma | [Co (H2O)4(OH)2] Moviy / yashil Cho'kma | [Cu (H2O)4(OH)2] Moviy Cho'kma | [Al (OH)4]− Rangsiz Qaror | [Cr (OH)6]3− Yashil Qaror |
| NH3, suyultiriladi | [Fe (NH.)3)6]2+ To'q yashil Cho'kma | [Fe (NH.)3)6]3+ jigarrang Cho'kma | [Co (NH3)6]2+ Somon rangli Qaror | [Cu (NH3)4(H2O)2]2+ To'q ko'k Qaror | [Al (NH3)3]3+ Oq Cho'kma | [Cr (NH3)6]3+ Siyohrang Qaror |
| NH3, jamlangan | [Fe (NH.)3)6]2+ To'q yashil Cho'kma | [Fe (NH.)3)6]3+ jigarrang Cho'kma | [Co (NH3)6]2+ Somon rangli Qaror | [Cu (NH3)4(H2O)2]2+ To'q ko'k Qaror | [Al (NH3)3]3+ Oq Cho'kma | [Cr (NH3)6]3+ Siyohrang Qaror |
| (CO3)2- | FeCO3 To'q yashil Cho'kma | Fe2(CO3)3 jigarrang Cho'kma + pufakchalar | COCO3 Pushti Cho'kma | CuCO3 Moviy / yashil Cho'kma |
Lantanid komplekslarining ranglari
Yuzaki lantanid majmualari o'tish rangidagi metallarga o'xshaydi, chunki ba'zilari rangli. Biroq, umumiy Ln uchun3+ ionlari (Ln = lantanid) ranglari hammasi rangpar bo'lib, ligand tabiatiga deyarli ta'sir qilmaydi. Ranglar 4f elektron o'tish bilan bog'liq. Lantanidlar tarkibidagi 4f orbitallar ksenon yadrosiga "ko'milgan" va 5s va 5p orbitallar tomonidan liganddan himoyalanganligi sababli, ularga ligandlar ta'sir qilmaydi, bu juda kichikroq kristalli maydon o'tish metallariga qaraganda bo'linish. Ln ning yutilish spektrlari3+ ioni elektron holatlar tasvirlangan erkin ionga yaqinlashadi spin-orbitaning ulanishi. Bu asosiy holat kristalli maydon bilan bo'linadigan o'tish metallariga qarama-qarshi. Ln uchun yutilishlar3+ kuchsiz, chunki elektr dipolli o'tish taqiqlangan (Laport taqiqlangan ), ammo past simmetriya ligand maydonining ta'siri yoki yuqori elektron holatlar bilan aralashishi tufayli intensivlikni kuchaytirishi mumkin (masalan. d orbitallar). f-f assimilyatsiya diapazonlari nihoyatda keskin bo'lib, odatda keng polosalarga ega bo'lgan o'tish metallari uchun kuzatilganlarga ziddir.[21][22] Bu juda noodatiy ta'sirlarga olib kelishi mumkin, masalan, yorug'likning turli shakllari ostida ranglarning sezilarli o'zgarishi.
Magnetizm
Juft bo'lmagan elektronlarga ega bo'lgan metall komplekslar magnit. Faqatgina monometalik komplekslarni hisobga olsak, juft bo'lmagan elektronlar, chunki bu kompleks elektronlarning g'alati soniga ega yoki elektronlar juftligi beqarorlashganligi sababli paydo bo'ladi. Shunday qilib, monomerik Ti (III) turlari bitta "d-elektron" ga ega va bo'lishi kerak (para) magnit, geometridan yoki ligandlarning tabiatidan qat'iy nazar. Ti (II), ikkita d-elektronga ega bo'lib, ikkita juftlanmagan elektronga, boshqalari esa yo'q bo'lgan ba'zi komplekslarni hosil qiladi. Ushbu ta'sir TiX birikmalari bilan tasvirlangan2[(CH3)2PCH2CH2P (CH3)2]2: qachon X =Cl, kompleks paramagnetik (yuqori spin konfiguratsiya), X = bo'lgandaCH3, bu diamagnetik (past aylanadigan konfiguratsiya). Shuni anglash kerakki, ligandlar sozlashning muhim vositasi hisoblanadi asosiy holat xususiyatlari.
Alohida markazlarda toq miqdordagi elektronlar bo'lgan yoki yuqori spinli bo'lgan bi- va polimetalik komplekslarda vaziyat ancha murakkablashadi. Agar ikkita (yoki undan ko'p) metall markazlari o'rtasida o'zaro ta'sir (to'g'ridan-to'g'ri yoki ligand orqali) bo'lsa, elektronlar juftlashishi mumkin (antiferromagnitik birikma, natijada diamagnitik birikma hosil bo'ladi) yoki ular bir-birini kuchaytirishi mumkin (ferromagnitik birikma ). O'zaro ta'sir bo'lmaganida, ikkita (yoki undan ko'p) alohida metall markazlari o'zini ikkita alohida molekuladagidek tutishadi.
Reaktivlik
Komplekslar turli xil mumkin bo'lgan reaktivliklarni namoyish etadi:[23]
- Elektron o'tkazmalar
- Elektron o'tkazish (ET) metall ionlari o'rtasida ikkita alohida mexanizm orqali sodir bo'lishi mumkin, ichki va tashqi sferadagi elektron o'tkazmalar. Ichki soha reaktsiyasida, a ko'prikli ligand ET uchun kanal bo'lib xizmat qiladi.
- (Degeneratsiya) ligand almashinuvi
- Reaktivlikning muhim ko'rsatkichlaridan biri bu ligandlarning degenerativ almashinish tezligi. Masalan, koordinatali suvning almashinish tezligi [M (H)2O)6]n+ komplekslar 20 darajadan kattaroq o'zgarib turadi. Ligandlar ajralib chiqadigan va tezda tiklanadigan komplekslar labil deb tasniflanadi. Bunday labil komplekslar termodinamik jihatdan ancha barqaror bo'lishi mumkin. Odatda labil metall majmualari kam zaryadga ega (Na+), d-orbitallardagi elektronlar antibonding ligandlarga nisbatan (Zn2+) yoki kovalentlik etishmasligi (Ln3+, bu erda Ln har qanday lantanid). Metall majmuaning labilligi, shuningdek, iloji bo'lsa, yuqori aylanishga nisbatan past aylanadigan konfiguratsiyalarga bog'liq. Shunday qilib, yuqori spinli Fe (II) va Co (III) labil komplekslarni hosil qiladi, past spinli analoglar esa inertdir. Cr (III) faqat past spin holatida (kvartet) mavjud bo'lishi mumkin, chunki u yuqori rasmiy oksidlanish darajasi, orbitallarda M-L antibonding bo'lgan elektronlar yo'qligi va ortiqcha "ligand maydonini stabillashishi" bilan bog'liq. d3 konfiguratsiya.
- Assotsiativ jarayonlar
- To'ldirilmagan yoki yarim to'ldirilgan orbitallarga ega bo'lgan komplekslar ko'pincha substratlar bilan reaksiyaga kirishish qobiliyatini ko'rsatadi. Ko'pgina substratlar singlet tuproq holatiga ega; ya'ni ular yolg'iz elektron juftlariga ega (masalan, suv, omin, efir), shuning uchun bu substratlar metall markaz bilan reaksiyaga kirishish uchun bo'sh orbitalga muhtoj. Ba'zi substratlar (masalan, molekulyar kislorod) uchlik er holatiga ega bo'lish, natijada yarim to'lgan orbitalli metallar bunday substratlar bilan reaksiyaga kirishish tendentsiyasiga ega (shuni aytish kerakki dioksigen molekula ham yolg'iz juftlarga ega, shuning uchun u "normal" Lyuis bazasi sifatida reaksiyaga kirisha oladi).
Agar metall atrofidagi ligandlar ehtiyotkorlik bilan tanlangan bo'lsa, metall yordam berishi mumkin (stexiometrik yoki katalitik ) molekulalarning o'zgarishi yoki sensor sifatida ishlatilishi mumkin.
Tasnifi
Koordinatsion birikmalar deb ham ataladigan metall komplekslariga deyarli barcha metall birikmalar kiradi.[24] "Muvofiqlashtiruvchi kimyo" ni o'rganish bu "noorganik kimyo" ni o'rganishdir gidroksidi va gidroksidi er metallari, o'tish metallari, lantanoidlar, aktinidlar va metalloidlar. Shunday qilib, koordinatsion kimyo davriy jadvalning ko'pchiligining kimyosi. Metall va metall ionlari, hech bo'lmaganda quyultirilgan fazalarda, faqat ligandlar bilan o'ralgan.
Koordinatsion kimyo sohalari ligandlar tabiatiga ko'ra keng ma'noda tasniflanishi mumkin:
- Klassik (yoki "Verner Komplekslar "): Klassik koordinatsion kimyo bo'yicha ligandlar metallarga deyarli faqatgina ular orqali bog'lanadi yolg'iz juftliklar ligandning asosiy guruh atomlarida yashovchi elektronlar. Odatda ligandlar H2O, NH3, Cl−, CN−, uz. Bunday komplekslarning eng oddiy a'zolarining ba'zilari tasvirlangan metall akvokomplekslar, metall ammin komplekslari,
- Misollar: [Co (EDTA )]−, [Co (NH3)6]3+, [Fe (C2O4)3]
- Organometalik kimyo: ligandlar organik (alkenlar, alkinlar, alkillar), shuningdek fosfinlar, gidrid va CO kabi "organik o'xshash" ligandlardir.
- Misol: (C5H5) Fe (CO)2CH3
- Bioinorganik kimyo: Ligandlar tabiat tomonidan ta'minlanadi, ayniqsa aminokislotalarning yon zanjirlari va boshqalar. kofaktorlar kabi porfirinlar.
- Misol: gemoglobin o'z ichiga oladi heme, temirning porfirin kompleksi
- Misol: xlorofill tarkibida magniyning porfirin kompleksi mavjud
- Ko'plab tabiiy ligandlar "klassik", ayniqsa suv.
- Klaster kimyosi: ligandlarga yuqorida aytilganlarning hammasi, shuningdek boshqa metall ionlari yoki atomlari kiradi.
- Misol Ru3(CO)12
- Ba'zi hollarda turli sohalarning kombinatsiyalari mavjud:
- Misol: [Fe4S4(Skisteinil)4]2−, unda klaster biologik faol turga kiritilgan.
Mineralogiya, materialshunoslik va qattiq moddalar kimyosi - ular metall ionlariga taalluqli - bu metallar ligandlar bilan o'ralgan degan ma'noda koordinatsion kimyoning kichik to'plamlari. Ko'pgina hollarda, bu ligandlar oksidlar yoki sulfidlardir, ammo shunga qaramay metallar muvofiqlashtiriladi va quyida keltirilgan printsiplar va ko'rsatmalar qo'llaniladi. Yilda hidratlar, hech bo'lmaganda ligandlarning bir qismi suv molekulalari. To'g'ri, mineralogiya, materialshunoslik va qattiq jismlar kimyosi odatdagi koordinatsiya yoki noorganik kimyo markazidan farq qiladi. Birinchisi, birinchi navbatda, juda ko'p o'zaro bog'liq bo'lgan metallarning kollektiv ta'siridan kelib chiqadigan xususiyatlar, polimer tuzilmalar bilan bog'liq. Aksincha, koordinatsion kimyo reaktivlikka va individual metall atomlarini yoki metall atomlarining kichik ansambllarini o'z ichiga olgan komplekslarning xususiyatlariga e'tibor beradi.
Muvofiqlashtiruvchi komplekslarning nomlanishi
Kompleksga nom berishning asosiy tartibi:
- Murakkab ionni nomlashda ligandlar metall ioni oldida nomlanadi.
- Ligandlarning nomlari alifbo tartibida berilgan. Raqamli prefikslar tartibga ta'sir qilmaydi.
- Ko'p sonli monodentat ligandlar paydo bo'lish soniga ko'ra prefiks oladi: ikki xil, uch, tetra-, penta-, yoki hexa-.
- Ko'p polidentat ligandlari (masalan, etilendiamin, oksalat) oladi bis-, tris-, tetrakis-, va boshqalar.
- Anionlar tugaydi o. Bu anion "-ide", "-ate" yoki "-ite" bilan tugaganida yakuniy "e" o'rnini bosadi, masalan. xlorid bo'ladi xlorido va sulfat bo'ladi sulfat. Ilgari '-ide' '-o' ga o'zgartirilgan (masalan. xlor va siyano), ammo bu qoida 2005 yilgi IUPAC tavsiyalarida o'zgartirilgan va ushbu ligandlar uchun to'g'ri shakllar hozirda mavjud xlorido va siyanido.[25]
- Neytral ligandlarga odatiy nomi berilgan, ba'zi istisnolar bundan mustasno: NH3 bo'ladi amin; H2O bo'ladi akva yoki akva; CO bo'ladi karbonil; YO'Q bo'ladi nitrosil.
- Markaziy atom / ionning nomini yozing. Agar kompleks anion bo'lsa, markaziy atomning nomi tugaydi -yoshva uning lotincha nomi mavjud bo'lsa ishlatiladi (simobdan tashqari).
- Markaziy atomning oksidlanish darajasi aniqlanishi kerak (agar u bir necha mumkin bo'lganlardan biri bo'lsa yoki nol bo'lsa) va qavs ichiga olingan rim raqami (yoki 0) sifatida yozilishi kerak.
- Kation nomidan oldin anion nomi yozilishi kerak. (agar kerak bo'lsa, oxirgi misolda bo'lgani kabi)
Misollar:
| metall | ga o'zgartirildi |
|---|---|
| kobalt | kobaltat |
| alyuminiy | aluminat |
| xrom | xromat |
| vanadiy | vanadat |
| mis | kuprat |
| temir | ferrat |
- [CD (CN)2(uz)2] → ditsianidobis (etilendiamin) kadmiy (II)
- [CoCl (NH3)5] SO4 → pentaamminekloridokobalt (III) sulfat
- [Cu (H2O)6] 2+ → geksakaakopper (II) ioni
- [CuCl5NH3]3− → amminepentaxloridokuprat (II) ioni
- K4[Fe (CN)6] → kaliy geksatsianidoferrat (II)
- [NiCl4]2− → tetrakloridonikkelat (II) ioni (Xlor- dan foydalanish IUPAC nomlash konvensiyasidan chiqarildi)[26]
Bir nechta metallarga biriktirilgan ligandlarning koordinatsion soni (ko'prikli ligandlar) yunoncha belgining pastki yozuvida ko'rsatilgan m ligand nomidan oldin joylashtirilgan. Shunday qilib dimer ning alyuminiy triklorid Al tomonidan tasvirlangan2Cl4(m2-Cl)2.
Har qanday anion guruhi har qanday kation bilan elektron stabillashishi mumkin. Anion kompleksi vodorod kationi bilan barqarorlashib, kationli vodorodni ajratish uchun dissotsiatsiyalanadigan kislotali kompleksga aylanadi. Ushbu turdagi murakkab birikma markaziy metalldan keyin "ic" qo'shilgan nomga ega. Masalan, H2[Pt (CN)4] tetratsyanoplatinik (II) kislota nomiga ega.
Barqarorlik doimiy
Metall ionlarining ligandlarga yaqinligi barqarorlik konstantasi bilan tavsiflanadi, shuningdek shakllanish konstantasi deb nomlanadi va K belgisi bilan ifodalanadi.f. Bu muvozanat doimiysi uni tarkibidagi metall va ligandlardan yig'ish uchun va shunga o'xshash tarzda hisoblash mumkin, oddiy misol uchun quyidagi misolda:
- (X) metall(aq) + (Y) Lyuis Bazasi(aq) ⇌ (Z) kompleks ioni(aq)
bu erda X, Y va Z stexiometrik har bir turning koeffitsientlari. Formatsiya konstantalari juda katta farq qiladi. Katta qiymatlar, tizimning muvozanat holatida bo'lishi sharti bilan, metalning ligandga yuqori yaqinligini ko'rsatadi.[27]
Ba'zan barqarorlik konstantasi barqarorlikning doimiyligi deb nomlanadigan boshqa shaklda bo'ladi. Ushbu doimiy kontsentratsiyaning teskari tomoni sifatida ifodalanadi va K deb belgilanadid = 1 / Kf .[28] Ushbu doimiy doimiy kompleks ionni uning alohida metall va ligand tarkibiy qismlariga parchalanishi uchun teskari reaktsiyani anglatadi. K uchun qiymatlarni taqqoslagandad, qiymat qanchalik katta bo'lsa, murakkab ion shunchalik beqaror bo'ladi.
Ushbu murakkab ionlarning eritmalarda hosil bo'lishi natijasida ular boshqa birikmalarning eruvchanligida asosiy rol o'ynashi mumkin. Murakkab ion hosil bo'lganda u eritmadagi tarkibiy qismlarning konsentratsiyasini o'zgartirishi mumkin. Masalan:
- Ag+
(aq) + 2NH4OH(aq) ⇌ Ag (NH3)+
2 + H2O
- AgCl(lar) + H2O(l) ⇌ Ag+
(aq) + Cl−
(aq)
Agar bu reaktsiyalar ikkalasi bir xil reaksiya idishida sodir bo'lgan bo'lsa, kumush xloridning eruvchanligi NH borligi bilan ortadi4OH, chunki Diammine argentum (I) kompleksining hosil bo'lishi eritmadan erkin kumush ionlarining muhim qismini iste'mol qiladi. By Le Shatelier printsipi, bu mahsulot sifatida kumush ioniga ega bo'lgan kumush xloridning erishi uchun muvozanat reaktsiyasini o'ngga siljishiga olib keladi.
Ushbu yangi eruvchanlikni K qiymatlarini hisobga olgan holda hisoblash mumkinf va Ksp asl reaktsiyalar uchun. Eriydiganlik asosan ikkita alohida muvozanatni bitta qo'shma muvozanat reaktsiyasiga birlashtirish orqali topiladi va bu qo'shma reaktsiya yangi eruvchanlikni aniqlaydi. Shunday qilib Kv, yangi eruvchanlik konstantasi quyidagicha belgilanadi:
Muvofiqlashtiruvchi birikmalarni qo'llash
Metalllar faqat koordinatsion komplekslar sifatida eritmada mavjud, shundan kelib chiqadiki, bu birikmalar klassi har xil usullarda foydalidir.
Bioinorganik kimyo
Yilda bioinorganik kimyo va bioorganometalik kimyo, koordinatsion komplekslar strukturaviy yoki katalitik funktsiyalarni bajaradi. Taxminan 30% oqsillar tarkibida metall ionlari mavjud. Masalan, zich ranglarni o'z ichiga oladi B vitamini12, gem guruhi yilda gemoglobin, sitoxromlar, xlor guruhi yilda xlorofill va karboksipeptidaza, hazm qilishda muhim bo'lgan gidrolitik ferment. Yana bir murakkab ion fermenti katalaza, bu hujayraning chiqindilarini parchalaydi vodorod peroksid. Sintetik koordinatsion birikmalar oqsillarni va ayniqsa nuklein kislotalarni (masalan, saratonga qarshi dori) bog'lash uchun ham ishlatiladi sisplatin ).
Sanoat
Bir hil kataliz organik moddalar ishlab chiqarish uchun koordinatsion birikmalarning asosiy qo'llanilishi. Jarayonlar o'z ichiga oladi gidrogenlash, gidroformillanish, oksidlanish. Bitta misolda titanium triklorid va trietilaluminiyum kombinatsiyasi kelib chiqadi Ziegler-Natta katalizatorlari uchun ishlatiladi polimerizatsiya tolalar, plyonkalar va plastmassalar sifatida katta tijorat ahamiyatiga ega bo'lgan polimerlarni olish uchun etilen va propilendan iborat.
Nikel, kobalt va mis yordamida qazib olish mumkin gidrometallurgiya jarayonlari murakkab ionlarni o'z ichiga oladi. Ular o'z rudalaridan shunday olinadi amin komplekslar. Murakkab ionlarning selektiv yog'inlanishi va eruvchanligi yordamida metallarni ham ajratish mumkin. Siyanid asosan oltin va kumushni ularning rudalaridan ajratib olish uchun ishlatiladi.
Ftalosiyanin komplekslar pigmentlarning muhim sinfidir.
Tahlil
Bir vaqtning o'zida namunadagi metallarning mavjudligini aniqlash uchun koordinatsion birikmalar ishlatilgan. Sifatli noorganik tahlil kabi instrumental tahlil usullari bilan almashtirildi atom yutilish spektroskopiyasi (AAS), induktiv ravishda bog'langan plazma atomik emissiya spektroskopiyasi (ICP-AES) va induktiv ravishda bog'langan plazma mass-spektrometriyasi (ICP-MS).
Shuningdek qarang
- Faollashtirilgan kompleks
- Anorganik kimyo IUPAC nomenklaturasi
- Muvofiqlashtiruvchi qafas
- Muvofiqlashtirish geometriyasi
- Muvofiqlashtirish izomeriyasi
- Muvofiqlashtiruvchi polimerlar, unda koordinatsion komplekslar takrorlanadigan birliklardir.
- Inklyuziv birikmalar
- Organometalik kimyo organik bo'laklar hech bo'lmaganda bitta S atom orqali metallga bog'langan maxsus koordinatsion birikmalar klassi bilan shug'ullanadi.
Adabiyotlar
- ^ Lawrance, Geoffrey A. (2010). Muvofiqlashtiruvchi kimyoga kirish. Vili. doi:10.1002/9780470687123. ISBN 9780470687123.
- ^ IUPAC, Kimyoviy terminologiya to'plami, 2-nashr. ("Oltin kitob") (1997). Onlayn tuzatilgan versiya: (2006–) "murakkab ". doi:10.1351 / goldbook.C01203
- ^ IUPAC, Kimyoviy terminologiya to'plami, 2-nashr. ("Oltin kitob") (1997). Onlayn tuzatilgan versiya: (2006–) "muvofiqlashtiruvchi shaxs ". doi:10.1351 / goldbook.C01330
- ^ Grinvud, Norman N.; Earnshaw, Alan (1997). Elementlar kimyosi (2-nashr). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ "Muvofiqlashtirish sohasining ta'rifi". kimyo-dungi.com.
- ^ "Muvofiqlashtiruvchi birikma nima?". Purdue universiteti kimyo kafedrasi.
- ^ Paxta, Frank Albert; Jefri Uilkinson; Karlos A. Murillo (1999). Ilg'or anorganik kimyo. p. 1355. ISBN 978-0-471-19957-1.
- ^ Miessler, Gari L.; Donald Artur Tarr (1999). Anorganik kimyo. p. 642. ISBN 978-0-13-841891-5.
- ^ "Muvofiqlashtiruvchi birikma".
- ^ Verner, A. (1911 yil may). "Zur Kenntnis des asymmetrischen Kobaltatoms. Men". Berichte der deutschen chemischen Gesellschaft (nemis tilida). 44 (2): 1887–1898. doi:10.1002 / cber.19110440297.
- ^ Uells A.F. (1984) Strukturaviy noorganik kimyo 5-nashr Oksford Ilmiy nashrlari ISBN 0-19-855370-6
- ^ Anjelo R. Rossi; Roald. Hoffmann (1975). "O'tish davri pentakordinatsiyasi". Anorganik kimyo. 14 (2): 365–374. doi:10.1021 / ic50144a032.
- ^ Roald. Xofmann; Barbara F. Beier; Earl L. Muetterties; Angelo R. Rossi (1977). "Etti koordinatsiya. Tarkibi, stereokimyosi va reaktsiya dinamikasini molekulyar orbital tadqiq qilish". Anorganik kimyo. 16 (3): 511–522. doi:10.1021 / ic50169a002.
- ^ Jeremi K. Burdett; Roald Xofmann; Robert C. Fay (1978). "Sakkizta muvofiqlashtirish". Anorganik kimyo. 17 (9): 2553–2568. doi:10.1021 / ic50187a041.
- ^ Kaupp, Martin (2001). ""VSEPRga tegishli bo'lmagan "tuzilmalar va bog'lash0 Tizimlar ". Angew. Kimyoviy. Int. Ed. Ingl. 40 (1): 3534–3565. doi:10.1002 / 1521-3773 (20011001) 40:19 <3534 :: AID-ANIE3534> 3.0.CO; 2- #.
- ^ fon Zelevskiy, A. "Muvofiqlashtiruvchi aralashmalarning stereokimyosi" Jon Vili: Chichester, 1995 y. ISBN 0-471-95599-X.
- ^ Miessler, Gari L.; Donald Artur Tarr (1999). "9". Anorganik kimyo. 315, 316 betlar. ISBN 978-0-13-841891-5.
- ^ a b v Xuey, Jeyms E., Anorganik kimyo (3-nashr, Harper & Row 1983), s.524-5 ISBN 0-06-042987-9
- ^ Xuey, Jeyms E., Anorganik kimyo (3-nashr, Harper & Row 1983), s.513-24 ISBN 0-06-042987-9
- ^ Xarris, D.; Bertoluchchi, M. (1989). Simmetriya va spektroskopiya. Dover nashrlari.
- ^ Paxta, F. Albert; Uilkinson, Jefri; Murillo, Karlos A .; Bochmann, Manfred (1999), Ilg'or anorganik kimyo (6-nashr), Nyu-York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Paxta, Simon (2006). Lantanid va aktinid kimyosi. John Wiley & Sons Ltd.
- ^ R. G. Uilkins kinetika va o'tish metall komplekslarining reaktsiyalar mexanizmi, 2-nashr, VCH, Vaynxaym, 1991 y. ISBN 1-56081-125-0
- ^ Istisno: metall bug'lari, plazmalar va qotishmalar.
- ^ "Anorganik kimyo nomenklaturasi IUPAC tavsiyalari 2005 yil" (PDF). IUPAC. 1.6.4-bo'lim (10-11-betlar). Arxivlandi asl nusxasi (PDF) 2014-12-22 kunlari. Olingan 2016-03-06.
- ^ "Anorganik kimyo nomenklaturasi IUPAC tavsiyalari 2005 yil" (PDF). IUPAC. 1.6.4-bo'lim (10-11-betlar). Arxivlandi asl nusxasi (PDF) 2014-12-22 kunlari. Olingan 2016-03-06.
- ^ "Murakkab ion muvozanati".
- ^ Stretton, Tom. "Eriydiganlik va kompleks-ion muvozanati" (PDF).
Qo'shimcha o'qish
- De Vito, D.; Weber, J.; Merbach, A. E. "t bo'yicha suv almashinuvi uchun hisoblangan hajm va energiya profillari2g 6 Rodiy (III) va Iridiy (III) Hexaaquaions: I uchun aniq dalillara Mexanizm ”Noorganik kimyo, 2004 y., 43-jild, 858–863-betlar. doi:10.1021 / ic035096n
- Zumdahl, Steven S. Kimyoviy printsiplar, Beshinchi nashr. Nyu-York: Xyuton Mifflin, 2005. 943-946, 957. OCLC 77760970
- Xarris, D., Bertoluchchi, M., Simmetriya va spektroskopiya. 1989 yil Nyu-York, Dover nashrlari










![{displaystyle K_{f}={frac {[{ ext{Complex ion}}]^{Z}}{[{ ext{Metal ion}}]^{X}[{ ext{Lewis base}}]^{Y}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4126a8afae00c2b0773a00eea6e33c27517b0b2)
