Glutation S-transferaza - Glutathione S-transferase
| Glutation S-transferaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
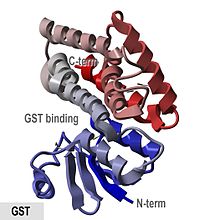 Glutationning kristallografik tuzilishi S- dan transfer Anofellar krakenslari.[1] | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 2.5.1.18 | ||||||||
| CAS raqami | 50812-37-8 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Glutation S-transferazlar (GSTlar), ilgari sifatida tanilgan ligandinlar, eukaryotik va prokaryotik oilani o'z ichiga oladi II bosqich metabolik izozimlar qobiliyatlari bilan eng yaxshi tanilgan kataliz qiling ning qisqartirilgan shakli konjugatsiyasi glutation (GSH) ga ksenobiotik substratlar zararsizlantirish maqsadida. GST oilasi uchta superfiliyadan iborat: sitosolik, mitoxondrial va mikrosomal -shuningdek, nomi bilan tanilgan MAPEG —oqsillar.[1][2][3] GST superfamilasining a'zolari juda xilma-xildir aminokislotalar ketma-ketligi va ommaviy ma'lumotlar bazalarida saqlanadigan ketma-ketliklarning katta qismi noma'lum funktsiyaga ega.[4] The Fermentlarning ishlashiga oid tashabbus (EFI) yangi GST funktsiyalarini aniqlash uchun GSTlarni superfamilaning namunasi sifatida ishlatmoqda.
GSTlar ba'zi sutemizuvchilar organlarida sitosolik oqsilning 10% gacha bo'lishi mumkin.[5][6] GSTlar birikmalarni suvda eruvchan holga keltirish uchun GSH kon'yugatsiyasini - sulfhidril guruhi orqali - turli xil substratlardagi elektrofil markazlarga kataliz qiladi.[7][8] Ushbu faoliyat kabi endogen birikmalarni zararsizlantiradi peroksidlangan lipidlar va ksenobiotiklarning parchalanishiga imkon beradi. GSTlar toksinlarni bog'lashi va transport oqsillari vazifasini bajarishi mumkin, bu esa GSTlar uchun erta davrni keltirib chiqardi, ligandin.[9][10]
Tasnifi
| Glutation S-transferaza, C- terminali domen | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikatorlar | |||||||||
| Belgilar | GST_C | ||||||||
| Pfam | PF00043 | ||||||||
| InterPro | IPR004046 | ||||||||
| SCOP2 | 2gst / QOIDA / SUPFAM | ||||||||
| OPM superfamily | 178 | ||||||||
| OPM oqsili | 5i9k | ||||||||
| CDD | cd00299 | ||||||||
| |||||||||
Oqsillar ketma-ketligi va tuzilishi uchta uchun muhim qo'shimcha tasnif mezonidir superfamilalar (sitosolik, mitoxondriyal va MAPEG) GSTlar: GSTlarning sitozolik superfamilasi sinflari 40% dan ko'prog'iga ega ketma-ketlik gomologiyasi, boshqa sinflardan kelganlar 25% dan kam bo'lishi mumkin. Sitosolik GSTlar tuzilishiga qarab 13 sinfga bo'linadi: alfa, beta, delta, epsilon, zeta, teta, mu, nu, pi, sigma, tau, phi va omega. Mitoxondrial GSTlar sinf kappasida. Mikrosomal GSTlarning MAPEG superfamilasi I-IV belgilangan kichik guruhlardan iborat bo'lib, ular orasida aminokislota ketma-ketliklar 20% dan kam identifikatsiyaga ega. Odamning sitosolik GSTlari alfa, zeta, teta, mu, pi, sigma va omega sinflariga mansub, MAPEG superfamilasining I, II va IV sinflariga tegishli oltita izozim mavjud.[8][12][13]
Nomenklatura
Birinchi marta 1992 yilda taklif qilingan standartlashtirilgan GST nomenklaturasi, qiziqish izozimasi tegishli bo'lgan turlarni GST qisqartmasidan oldin kichik harflar bilan bosh harf bilan (masalan, odam uchun "h") aniqlaydi. Keyinchalik izozimlar klassi katta harf bilan aniqlanadi (masalan, alfa uchun "A"), so'ngra sinfni ifodalovchi arabcha raqam subfamily (yoki subunit). Ham mitoxondriyal, ham sitozolli GSTlar mavjud bo'lib dimerlar va bir xil sinf vakillari o'rtasida faqat heterodimerlar hosil bo'ladi, ferment dimerining ikkinchi subfamily komponenti defis bilan belgilanadi, so'ngra qo'shimcha arabcha raqam qo'yiladi.[12][13] Shuning uchun, agar inson glutation bo'lsa S-transferaza - pi-klass subfamilasi 1-da homodimer, uning nomi "hGSTP1-1" deb yoziladi.
GSTlar uchun dastlabki nomenklaturada ularni "Y" oqsillari deb atashgan, ularning "Y" fraktsiyasida ("X va Z" fraktsiyalaridan farqli o'laroq) Sephadex G75 xromatografiyasidan foydalangan holda.[14] GST kichik birliklari aniqlanganda ular kerak bo'lganda Ya, Yp va boshqalar deb nomlangan, agar kerak bo'lsa, monomer izoformini aniqlaydigan raqam (masalan, Yb1). Litvak va boshq ilgari "Y" oqsillari sifatida tanilgan oqsillarni qoplash uchun "Ligandin" atamasini taklif qildi.[10]
Klinik kimyo va toksikologiyada alfa GST, mu GST va pi GST atamalari eng ko'p qo'llaniladi.
Tuzilishi
| Identifikatorlar | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Belgilar | GST_N | ||||||||
| Pfam | PF02798 | ||||||||
| Pfam klan | CL0172 | ||||||||
| InterPro | IPR004045 | ||||||||
| PROSITE | PS50404 | ||||||||
| SCOP2 | 1g7o / QOIDA / SUPFAM | ||||||||
| |||||||||
Glutation bilan bog'lanish joyi yoki "G-sayt" bu erda joylashgan tioredoksin - sitozol va mitoxondriyal GSTlarning domeniga o'xshash. Turli sinflar orasidagi eng katta o'zgaruvchanlikni o'z ichiga olgan mintaqa quyidagilardir spiral a2, bu erda uch xil aminokislota qoldiqlaridan biri va glitsin glutationning qoldig'i. Glyutation bilan o'zaro ta'siriga qarab sitosolik GSTlarning ikkita kichik guruhlari xarakterlanadi: Y-GST guruhi tirozin glutationni faollashtirish uchun qoldiq va uning o'rniga ishlatadigan S / C-GST serin yoki sistein qoldiqlar.[8][15]
- "GST oqsillari an N- termal aralash spiral va beta-strand domeni va all-spiral C- terminali domen. "
The cho'chqa go'shti pi-klass fermenti pGTSP1-1 birinchi marta GST bo'lib, uning tuzilishini aniqladi va u sitozol GST superfamilasining boshqa a'zolari vakili hisoblanadi. tioredoksinga o'xshash N-Terminal domen, shuningdek C-Terminal dan iborat bo'lgan domen alfa spirallari.[8][16]
Sutemizuvchi sitosolik GSTlar dimerik, ikkala subbirlik ham bir xil GST sinfiga mansub bo'lsa ham, bir xil bo'lishi shart emas. The monomerlar hajmi taxminan 25 kDa.[12][17] Ular sezilarli darajada bir-biriga o'xshash turli xil substratlarda faoldir.[18] Quyidagi jadvalda mavjud bo'lgan har bir sinfning barcha GST fermentlari keltirilgan Homo sapiens, topilganidek UniProtKB / Shveytsariya-Prot ma'lumotlar bazasi.
| GST klassi | Homo sapiens GST sinf a'zolari (22) |
|---|---|
| Alfa | GSTA1, GSTA2, GSTA3, GSTA4, GSTA5 |
| Delta | |
| Kappa | GSTK1 |
| Mu | GSTM1, GSTM1L (RNAi), GSTM2, GSTM3, GSTM4, GSTM5 |
| Omega | GSTO1, GSTO2 |
| Pi | GSTP1 |
| Teta | GSTT1, GSTT2, GSTT4 |
| Zeta | GSTZ1 (aka MAAI-Maleylacetoacetate izomerase) |
| Mikrosomal | MGST1, MGST2, MGST3 |
Funktsiya
GSTlarning faolligi sintetik fermentlardan doimiy ravishda GSH ta'minotiga bog'liq gamma-glutamilsistein sintetaza va glutation sintetaza, shuningdek, GSH konjugatlarini hujayradan olib tashlash uchun maxsus transport vositalarining harakati. GSTlarning asosiy roli katalizator yordamida ksenobiotiklarni zararsizlantirishdir nukleofil hujum elektropil uglerod, oltingugurt yoki azot atomlarida GSH tomonidan polar bo'lmagan ksenobiotik substratlarda, shu bilan ularning hal qiluvchi hujayra oqsillari va nuklein kislotalari bilan o'zaro ta'sirini oldini oladi.[13][19] Xususan, ushbu rolda GSTlarning funktsiyasi ikki xil: har ikkala substratni ferment gidrofobida bog'lash Hqo'shni, gidrofil G-maydonchasidagi sayt va GSH, ular birgalikda shakllanadi faol sayt fermentning; va keyinchalik .ni faollashtirish uchun tiol GSH guruhi, bu substratga nukleofil hujumini ta'minlaydi.[12] Glutation molekulasi orasidagi yoriqda bog'lanadi N- va C-terminal domenlar - katalitik ahamiyatga ega bo'lgan qoldiqlar N- terminali domen.[20] GST dimerining ikkala kichik birligi, tabiatan hetero- yoki homodimerik bo'lsin, bitta substrat biriktiruvchi joyni, shuningdek GSH bilan bog'lanish joyini o'z ichiga oladi. Sitosolik mu va alfa sinflari tomonidan hosil bo'lgan heterodimerik GST komplekslarida, ammo ikkita bo'linma orasidagi yoriq qo'shimcha yuqori afinitelli nonsubstrat ksenobiotik bog'lanish joyiga ega bo'lib, fermentlarning heterodimerlarni hosil qilish qobiliyatini hisobga olishi mumkin.[19][21]
Ushbu usulda GSTlar tomonidan yo'naltirilgan birikmalar turli xil ekologik yoki boshqa ekzogen toksinlarni, shu jumladan kimyoviy terapevtik vositalarni va boshqa dorilarni, pestitsidlarni, gerbitsidlarni, kanserogenlarni va o'zgaruvchan epoksidlarni o'z ichiga oladi; chindan ham, GSTlar β konjugatsiyasi uchun javobgardir1-8,9-epoksid, hosil bo'lgan reaktiv oraliq aflatoksin B1, bu kemiruvchilar tarkibidagi toksinlardan himoya qilishning hal qiluvchi vositasi. Detoksifikatsiya reaktsiyalari dastlabki to'rt bosqichni o'z ichiga oladi merkapturik kislota sintez,[19] GSH ga konjugatsiya bilan substratlarni yanada eruvchan qilish uchun xizmat qiladi va ularni ko'p dori-darmonlarga qarshilik ko'rsatadigan protein 1 (masalan, transportyorlar orqali hujayradan olib tashlashga imkon beradi)MRP1 ).[8] Eksportdan so'ng konjugatsiya mahsulotlari merkapturik kislotalarga aylanadi va ular orqali chiqariladi siydik yoki safro.[13]
Ko'pgina sutemizuvchilar izofermentlari substratga o'xshashlikka ega 1-xloro-2,4-dinitrobenzol va ushbu substratdan foydalanilgan spektrofotometrik tahlillar odatda GST faoliyati to'g'risida xabar berish uchun ishlatiladi.[22] Shu bilan birga, ba'zi bir endogen birikmalar, masalan, bilirubin, GSTlarning faolligini inhibe qilishi mumkin. Sutemizuvchilarda GST izoformalari hujayralarga xos taqsimotlarga ega (masalan, gepatotsitlarda a-GST va odam jigarining o't yo'llarida b-GST).[23]
Uyali signalizatsiyadagi roli

Ksenobiotiklarni GSH bilan konjugatsiya qilish va shu bilan hujayra muhitini zararsizlantirish qobiliyati bilan eng yaxshi tanilgan bo'lsa-da, GSTlar nonsubstratni bog'lashga qodir. ligandlar, muhim bilan hujayra signalizatsiyasi oqibatlari. Har xil sinflardan bir nechta GST izozimalari a funktsiyasini inhibe qilishi isbotlangan kinaz bilan bog'liq MAPK yo'li tartibga soluvchi hujayralar ko'payishi va o'lim, kinaz signalizatsiya kaskadini osonlashtirishda o'z rolini bajarishiga to'sqinlik qiladi.[24]
Sitozol GSTP1-1, sutemizuvchilar GST oilasining yaxshi xarakterli izozimasi, asosan yurak, o'pka va miya to'qimalarida ifodalanadi; aslida, bu jigar tashqarisida ifodalangan eng keng tarqalgan GST.[24][25] GSTP1-1 odam o'simta hujayralarining ko'pchiligida haddan tashqari ta'sirlanishiga va kimyoviy terapevtik chidamli o'smalarda tarqalishiga asoslanib, saraton rivojlanishida va uning potentsialida rol o'ynaydi qarshilik giyohvand moddalarni davolashga. Buning qo'shimcha dalillari shundan iboratki, GSTP tanlab inhibe qilishi mumkin C-Yun tomonidan fosforillanish JNK, apoptozning oldini olish.[24] Kam uyali stress paytida, to'g'ridan-to'g'ri murakkablik hosil bo'ladi oqsil va oqsillarning o'zaro ta'siri GSTP va C- JNK ta'sirini samarali ravishda oldini olish va shu bilan JNK yo'lini induktsiya qilish - JNK ning terminusi. Uyali oksidlovchi stress kompleksning ajralishiga, GSTP ning oligomerizatsiyasiga va JNK yo'lining induksiyasiga olib keladi, natijada apoptoz.[26] Pro-apoptotik JNK yo'lining GSTP inhibisyonu bilan izozimning dori-darmonlarga chidamli o'simta hujayralarida haddan tashqari ekspressioni o'rtasidagi bog'liqlikning o'zi o'simta hujayralarining GSTP substratlari bo'lmagan dorilar vositasida apoptozdan qutulish qobiliyatini hisobga olishi mumkin.[24]
GSTP singari, GSTM1 to'g'ridan-to'g'ri oqsil-oqsil o'zaro ta'siri orqali apoptotik yo'llarni boshqarishda ishtirok etadi, garchi u harakat qilsa ASK1 JNK oqimining yuqori qismida joylashgan. Mexanizm va natija GSTP va JNKnikiga o'xshashdir, chunki GSTM1 kompleks hosil bo'lishi orqali ASK1 sekvestrlarini o'tkazadi va uning proopopotik induktsiyasini oldini oladi p38 va MAPK signalizatsiya kaskadining JNK qismlari. GSTP singari, GSTM1 ham sherigi bilan oksidlovchi stress bo'lmagan holda o'zaro ta'sir qiladi, garchi ASK1 issiqlik zarbasi javob, bu ham ASK1 sekvestratsiyasi paytida oldini oladi. GSTning yuqori darajalari bir qator moddalar, shu jumladan kimyoviy terapevtik vositalar tomonidan kelib chiqadigan apoptozga chidamliligi bilan bog'liqligi uning MAPK signalizatsiyasining oldini olishdagi muhim rolini qo'llab-quvvatlaydi.[26]
Saraton rivojlanishining oqibatlari
GSTning, xususan GSTPning saraton rivojlanishida va kimyoviy terapevtik qarshilikdagi rolini qo'llab-quvvatlovchi dalillar tobora ko'payib bormoqda. GSTP va saraton o'rtasidagi bog'liqlik ko'pgina saraton kasalliklarida GSTPning haddan tashqari namoyon bo'lishida aniq namoyon bo'ladi, ammo shuni ko'rsatadiki, o'sma hujayralarining transformatsiyalangan fenotipi aberrant tarzda tartibga solinadigan kinaz signalizatsiya yo'llari va haddan tashqari ta'sirlangan oqsillarga uyali qaramlik bilan bog'liq. Saratonga qarshi dorilarning aksariyati GSTP uchun kambag'al substrat ekanligi shundan dalolat beradiki, o'simta hujayralarining ko'pchiligida yuqori darajadagi GSTP ning roli birikmalarni zararsizlantirish emas, balki boshqa maqsadga ega bo'lishi kerak; bu gipotezaga GSTP ning dori-darmonlarga chidamli bo'lmagan o'simta hujayralari chizig'ida ortiqcha ekspressionni umumiy topilishi ham ishonadi.[27]
Klinik ahamiyati
GSTlar saraton kasalligini rivojlanishidagi va kimyoviy terapevtik dori-darmonlarga chidamliligidan tashqari, GSH bilan bog'liqligi sababli turli xil kasalliklarga chalinadi. GSTning ta'siri uchun minimal dalillar bo'lsa-da polimorfizmlar alfa, mu, pi va teta sinflarining har xil saraton turlariga moyilligi bo'yicha, ko'plab tadqiqotlar bunday genotipik o'zgarishlarni keltirib chiqardi Astma, ateroskleroz, allergiya va boshqalar yallig'lanish kasalliklar.[19]
Chunki diabet Oksidlanish shikastlanishini o'z ichiga olgan kasallik va diabetik bemorlarda GSH metabolizmi noto'g'ri ishlaydi, GSTlar diabetik dori bilan davolash uchun potentsial maqsadni ko'rsatishi mumkin. Bunga qo'chimcha, insulin ma'muriyati orqali GST gen ekspresyonunun ko'payishiga olib kelishi ma'lum PI3K / AKT / mTOR yo'li va hujayra ichidagi oksidlanish stresini kamaytiradi glyukagon bunday gen ekspressionini pasaytiradi.[28]
Omega sinfidagi GST (GSTO) genlari, ayniqsa, nevrologik kasalliklar bilan bog'liq Altsgeymer, Parkinson va amiotrofik lateral skleroz; yana, oksidlovchi stress aybdor, deb ishoniladi, GSTO gen ekspressioni kamayadi, natijada kasalliklar paydo bo'lish yoshi pasayadi.[29]
Organlar shikastlanishining belgisi sifatida GSTlarning chiqarilishi
GSTlarning hujayra ichidagi yuqori konsentratsiyasi ularning hujayralarga xos uyali taqsimoti bilan bir qatorda ularning aniqlangan hujayra turlarining shikastlanishini lokalizatsiya qilish va kuzatish uchun biomarker sifatida ishlashga imkon beradi. Masalan, gepatotsitlar tarkibida alfa GST yuqori darajasi va alfa GST zardobida gepatotsitlar shikastlanishining ko'rsatkichi ekanligi aniqlandi transplantatsiya, toksiklik va virusli infektsiyalar.[30][31][32]
Xuddi shu tarzda, odamlarda buyrak proksimal quvur hujayralarida alfa GST yuqori konsentratsiyasi, distal quvur hujayralarida pi GST mavjud.[33] Ushbu o'ziga xos taqsimot buyrak tubulasi shikastlanishini aniqlash va lokalizatsiya qilish uchun siydik GSTlarini o'lchashga imkon beradi transplantatsiya, nefrotoksiklik va ishemik shikastlanish.[34]
Kemiruvchilarning klinikadan oldingi tadqiqotlarida siydik va zardob alfa GST buyrak proksimal tubulali va gepatotsitlar nekrozining sezgir va o'ziga xos ko'rsatkichlari ekanligi aniqlandi.[35][36]
GST-teglar va GST pastga tushiriladigan tahlil
A deb nomlanuvchi jarayonda eritmadan tozalash uchun GST qiziqishdagi oqsilga qo'shilishi mumkin pastga tushadigan tahlil. Bu GST DNK kodlash ketma-ketligini qiziqish oqsilining kodlari qatoriga qo'shish orqali amalga oshiriladi. Shunday qilib, transkripsiyadan va tarjimadan so'ng, GST oqsili va qiziqish oqsili birgalikda sifatida ifodalanadi birlashma oqsili. GST oqsili GSH uchun kuchli bog'lanish yaqinligiga ega bo'lgani uchun, aralashma bilan qoplangan boncuklar oqsil aralashmasiga qo'shilishi mumkin; Natijada, GSTga biriktirilgan qiziqish oqsili munchoqlarga yopishib, oqsilni eritmadagi qolganlardan ajratib turadi. Boncuklar qayta tiklanadi va bepul GSH bilan yuvilib, boncuklardan qiziqish oqsilini ajratadi, natijada tozalangan oqsil paydo bo'ladi. Ushbu usul oqsil va oqsillarning o'zaro ta'sirini aniqlash uchun ishlatilishi mumkin. Ushbu tahlilning kamchiliklari shundaki, qiziqish oqsili GSTga biriktirilgan bo'lib, uning asl holatini o'zgartiradi.[37][38]
GST-yorlig'i ko'pincha GST-termoyadroviy oqsilini o'z ichiga olgan oqsillarni ajratish va tozalash uchun ishlatiladi. Yorliq 220 aminokislotalar (taxminan 26 kDa) hajmda,[39] kabi teglar bilan taqqoslaganda Myc-teg yoki BAYRAK yorlig'i, juda katta. U ikkalasiga birlashtirilishi mumkin N-terminus yoki C-terminus oqsil. Biroq, GST etiketli plazmidlarning ko'plab savdo manbalarida quyidagilar mavjud trombin oqsilni tozalash paytida GST yorlig'ini ajratish uchun domen.[37][40]
Shuningdek qarang
- Qarindoshlik xromatografiyasi
- Bakterial glutation transferazasi
- Glutation S-transferaza Mu 1
- Glutation S-transferaza, C- terminali domen
- GSTP1
- Maltoza bilan bog'langan oqsil
- Protein yorlig'i
Adabiyotlar
- ^ a b PDB: 1R5A; Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (iyun 2005). "Delta sinfining yangi glutatyon transferaz izoenzimini aniqlash, tavsifi va tuzilishi". Biokimyoviy jurnal. 388 (Pt 3): 763-71. doi:10.1042 / BJ20042015. PMC 1183455. PMID 15717864.
- ^ Sheehan D, Meade G, Foley VM, Dowd CA (Noyabr 2001). "Glutation transferazlarining tuzilishi, funktsiyasi va evolyutsiyasi: qadimgi ferment superfamilyasining sutemizuvchilar bo'lmagan a'zolarini tasniflash uchun ta'siri". Biokimyoviy jurnal. 360 (Pt 1): 1-16. doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986.
- ^ Allocati N, Federici L, Masulli M, Di Ilio C (yanvar 2009). "Bakteriyalardagi glutation transferazlari". FEBS jurnali. 276 (1): 58–75. doi:10.1111 / j.1742-4658.2008.06743.x. PMID 19016852.
- ^ Atkinson HJ, Babbitt Kompyuter (Noyabr 2009). "Glutation transferazlari tioredoksin katlamidagi strukturaviy va funktsional chegaralar". Biokimyo. 48 (46): 11108–16. doi:10.1021 / bi901180v. PMC 2778357. PMID 19842715.
- ^ Boyer TD (mart 1989). "Glutation S-transferazlar: yangilanish ". Gepatologiya. 9 (3): 486–96. doi:10.1002 / hep.1840090324. PMID 2646197.
- ^ Mukanganyama S, Bezabih M, Robert M, Ngadjui BT, Kapche GF, Ngandeu F, Abegaz B (avgust 2011). "Yangi tabiiy mahsulotlarni inson glutation transferaz P1-1 inhibitori sifatida baholash". Fermentlarni inhibe qilish va tibbiy kimyo jurnali. 26 (4): 460–7. doi:10.3109/14756366.2010.526769. PMID 21028940. S2CID 41391243.
- ^ Duglas KT (1987). "Glutationga bog'liq fermentlarning ta'sir qilish mexanizmi". Enzimologiya va molekulyar biologiyaning tegishli sohalaridagi yutuqlar. Enzimologiya va molekulyar biologiyaning tegishli sohalaridagi yutuqlar. 59. pp.103–67. doi:10.1002 / 9780470123058.ch3. ISBN 9780470123058. PMID 2880477.
- ^ a b v d e Okli A (2011 yil may). "Glutation transferazlari: strukturaviy istiqbol". Giyohvand moddalar almashinuvi bo'yicha sharhlar. 43 (2): 138–51. doi:10.3109/03602532.2011.558093. PMID 21428697. S2CID 16400885.
- ^ Leaver MJ, Jorj SG (1998). "Pitsin glutation S- lipid peroksidatsiyasining oxirgi mahsulotlarini samarali ravishda konjuge qiluvchi transferaza ". Dengiz atrof-muhit tadqiqotlari. 46 (1–5): 71–74. doi:10.1016 / S0141-1136 (97) 00071-8.
- ^ a b Litvak G, Ketterer B, Arias IM (1971 yil dekabr). "Ligandin: steroidlar, bilirubin, kanserogenlar va bir qator ekzogen organik anionlarni bog'laydigan jigar oqsili". Tabiat. 234 (5330): 466–7. doi:10.1038 / 234466a0. PMID 4944188. S2CID 4216672.
- ^ PDB: 2GST; Ji X, Jonson VW, Sesay MA, Dikert L, Prasad SM, Ammon HL, Armstrong RN, Gilliland GL (1994 yil fevral). "Glutationning ksenobiotik substrat bilan bog'lanish joyining tuzilishi va vazifasi S-transferaza, 9- diastereomerlari bilan mahsulot komplekslarini rentgen-kristallografik tahlilida aniqlangan (S-glutatyonil) -10-gidroksi-9,10-dihidrofenantren ". Biokimyo. 33 (5): 1043–52. doi:10.1021 / bi00171a002. PMID 8110735.
- ^ a b v d Eaton DL, Bammler TK (iyun 1999). "Glutationni qisqacha ko'rib chiqish S-transferazlar va ularning toksikologiya uchun ahamiyati ". Toksikologik fanlar. 49 (2): 156–64. doi:10.1093 / toxsci / 49.2.156. PMID 10416260.
- ^ a b v d Jozefi PD (iyun 2010). "Inson glutation transfertaz fermentlarining genetik o'zgarishi: farmakologiya va toksikologiya uchun ahamiyati". Inson genomikasi va protomikasi. 2010: 876940. doi:10.4061/2010/876940. PMC 2958679. PMID 20981235.
- ^ Levi AJ, Gatmaitan Z, Arias IM (1969 yil noyabr). "Y va Z jigarining ikkita sitoplazmatik oqsil fraktsiyasi va ularning bilirubin, sulfobromoftalein va boshqa anionlarni jigarda qabul qilishdagi mumkin bo'lgan roli". Klinik tadqiqotlar jurnali. 48 (11): 2156–67. doi:10.1172 / JCI106182. PMC 297469. PMID 4980931.
- ^ Atkinson HJ, Babbitt Kompyuter (Noyabr 2009). "Glutation transferazlari tioredoksin qatlamidagi strukturaviy va funktsional chegaralar". Biokimyo. 48 (46): 11108–16. doi:10.1021 / bi901180v. PMC 2778357. PMID 19842715.
- ^ Park AK, Moon JH, Jang EH, Park H, Ahn IY, Li KS, Chi YM (2013 yil mart). "Qisqichbaqasimon baliqlarga xos GST sinf glutation S- Antarktika ikki qavatli laternula elliptica-dan transferaza yangi faol sayt arxitekturasini ochib beradi ". Oqsillar. 81 (3): 531–7. doi:10.1002 / prot.24208. PMID 23152139.
- ^ Landi S (2000 yil oktyabr). "GTA sutemizuvchilar sinfi tetiasi va kanserogenlarga nisbatan sezgirligi: sharh". Mutatsion tadqiqotlar. 463 (3): 247–83. doi:10.1016 / s1383-5742 (00) 00050-8. PMID 11018744.
- ^ Raza H (noyabr 2011). "Glutationni ikki tomonlama lokalizatsiyasi S- sitosol va mitoxondriyadagi transferaza: oksidlovchi stress, toksiklik va kasallikdagi ta'sirlar ". FEBS jurnali. 278 (22): 4243–51. doi:10.1111 / j.1742-4658.2011.08358.x. PMC 3204177. PMID 21929724.
- ^ a b v d Xeys JD, Flanagan JU, Jovsi IR (2005). "Glutation transferazlari". Farmakologiya va toksikologiyaning yillik sharhi. 45: 51–88. doi:10.1146 / annurev.pharmtox.45.120403.095857. PMID 15822171.
- ^ Nishida M, Harada S, Noguchi S, Satow Y, Inoue H, Takahashi K (Avgust 1998). "Uch o'lchovli tuzilishi Escherichia coli glutation S-transferaza glutation sulfanat bilan komplekslangan: katalitik rollar Cys10 va His106 ". Molekulyar biologiya jurnali. 281 (1): 135–47. doi:10.1006 / jmbi.1998.1927. PMID 9680481.
- ^ Vargo MA, Colman RF (2001 yil yanvar). "Sichqoncha glutationining yaqinligini belgilash S-transferaza izozimasi 1-1 va 17β-iodoasetoksi-estradiol-3-sulfat ". Biologik kimyo jurnali. 276 (3): 2031–6. doi:10.1074 / jbc.M008212200. PMID 11031273.
- ^ Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby JB (oktyabr 1974). "Glutationning o'ziga xosligi S-jigarning asosiy bog'lovchi oqsili bo'lgan ligandin bilan B-transferaza ". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 71 (10): 3879–82. doi:10.1073 / pnas.71.10.3879. PMC 434288. PMID 4139704.
- ^ Bkett GJ, Xeyz JD (1987). "Glutation S- odamda transferaza o'lchovlari va jigar kasalligi ". Klinik biokimyo va ovqatlanish jurnali. 2: 1–24. doi:10.3164 / jcbn.2.1.
- ^ a b v d Laborde E (sentyabr 2010). "Glutation transferazlari hujayraning ko'payishi va hujayra o'limida ishtirok etadigan signalizatsiya yo'llarining vositachisi sifatida". Hujayra o'limi va differentsiatsiyasi. 17 (9): 1373–80. doi:10.1038 / cdd.2010.80. PMID 20596078.
- ^ Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, Tew KD, Pincus MR, Sardana M, Henderson CJ, Wolf CR, Devis RJ, Ronai Z (mart 1999). "GSTp tomonidan JNK signalizatsiyasini tartibga solish". EMBO jurnali. 18 (5): 1321–34. doi:10.1093 / emboj / 18.5.1321. PMC 1171222. PMID 10064598.
- ^ a b Townsend DM, Tew KD (2003 yil oktyabr). "Glutationning roli -S- saratonga qarshi dori-darmonlarga qarshi transferaza ". Onkogen. 22 (47): 7369–75. doi:10.1038 / sj.onc.1206940. PMC 6361125. PMID 14576844.
- ^ Tew KD, Manevich Y, Grek C, Xiong Y, Uys J, Taunsend DM (iyul 2011). "Glutationning roli S-transferaza P signalizatsiya yo'llarida va S- saraton kasalligida glutationilatsiya ". Bepul radikal biologiya va tibbiyot. 51 (2): 299–313. doi:10.1016 / j.freeradbiomed.2011.04.013. PMC 3125017. PMID 21558000.
- ^ Franko R, Schoneveld OJ, Pappa A, Panayiotidis MI (2007). "Glutationning odam kasalliklari patofizyologiyasidagi markaziy roli". Fiziologiya va biokimyo arxivlari. 113 (4–5): 234–58. doi:10.1080/13813450701661198. PMID 18158646. S2CID 35240599.
- ^ PG kengashi (2011 yil may). "Omega sinfidagi glutation transferazlari: tuzilishi, funktsiyasi va genetikasi". Giyohvand moddalar almashinuvi bo'yicha sharhlar. 43 (2): 226–35. doi:10.3109/03602532.2011.561353. PMID 21495794. S2CID 27736207.
- ^ Bkett GJ, Chapman BJ, Dyson EH, Xeys JD (yanvar 1985). "Plazma glutation S-paratsetamolning haddan tashqari dozasidan keyin transferaza o'lchovlari: jigar hujayralari erta zararlanishiga dalil ". Ichak. 26 (1): 26–31. doi:10.1136 / gut.26.1.26. PMC 1432412. PMID 3965363.
- ^ Xyuz VF, Trull AK, Gimson A, Do'st PJ, Jeymison N, Dunkan A, Vayt DG, Prevost AT, Aleksandr GJ (1997 yil noyabr). "Sarum alfa-glutationning klinik afzalliklarini baholash uchun tasodifiy sinov S- jigar transplantatsiyasidan keyingi transferaza konsentratsiyasini kuzatish ". Transplantatsiya. 64 (10): 1446–52. doi:10.1097/00007890-199711270-00013. PMID 9392310.
- ^ Loguercio C, Caporaso N, Tuccillo C, Morisco F, Del Vecchio Blanco G, Del Vecchio Blanco C (mart 1998). "HCV bilan bog'liq bo'lgan surunkali gepatitda alfa-glutation transferazlari: interferon terapiyasiga javobning yangi bashorat qiluvchi ko'rsatkichi?". Gepatologiya jurnali. 28 (3): 390–5. doi:10.1016 / s0168-8278 (98) 80311-5. PMID 9551675.
- ^ Harrison DJ, Kharbanda R, Cunningham DS, McLellan LI, Hayes JD (iyun 1989). "Glutationning tarqalishi S- inson buyragidagi transferaza izoenzimlari: buyrak shikastlanishining mumkin bo'lgan belgilari uchun asos ". Klinik patologiya jurnali. 42 (6): 624–8. doi:10.1136 / jcp.42.6.624. PMC 1141991. PMID 2738168.
- ^ Sundberg AG, Appelkvist EL, Bekman L, Dallner G (1994). "Siydikdagi pi-klassli glutation transferazasi inson buyragidagi naychali shikastlanish ko'rsatkichi sifatida". Nefron. 67 (3): 308–16. doi:10.1159/000187985. PMID 7936021.
- ^ Harpur E, Ennulat D, Xofman D, Betton G, Gautier JK, Riefke B, Bounous D, Shuster K, Beushausen S, Guffroy M, Shaw M, Lock E, Pettit S (Avgust 2011). "Erkak kalamushining ikkita shtammidagi buyrak toksikligining kimyoviy ta'siridan kelib chiqqan biomarkerlarning biologik malakasi". Toksikologik fanlar. 122 (2): 235–52. doi:10.1093 / toxsci / kfr112. PMID 21593213.
- ^ Bailey WJ, Holder D, Patel H, Devlin P, Gonsales RJ, Hamilton V, Muniappa N, Hamlin DM, Tomas Idoralar, Sistare FD, Glaab WE (dekabr 2012). "Sichqoncha ichidagi uchta dori-darmonli jigar shikastlanishi biomarkerlarining samaradorligini baholash: alfa-glutation S-transferaza, arginaz 1 va 4-gidroksifenil-piruvat dioksigenaza " (PDF). Toksikologik fanlar. 130 (2): 229–44. doi:10.1093 / toxsci / kfs243. PMID 22872058.
- ^ a b Benard V, Bokoch GM (2002). "Qarindoshlik usullari bo'yicha Cdc42, Rac va Rho GTPase aktivatsiyasini tahlil qilish". G oqsillari yo'llari - C qismi, effektor mexanizmlari. Enzimologiyadagi usullar. 345. 349-59 betlar. doi:10.1016 / s0076-6879 (02) 45028-8. ISBN 9780121822460. PMID 11665618.
- ^ Ren L, Chang E, Makky K, Haas AL, Kaboord B, Valid Qoronfleh M (Noyabr 2003). "Glutation S- suvsiz immobilizatsiya qilingan glutation qatronidan foydalangan holda transferazni pastga tushirish tahlillari ". Analitik biokimyo. 322 (2): 164–9. doi:10.1016 / j.ab.2003.07.023. PMID 14596823.
- ^ Long F, Cho V, Ishii Y (sentyabr 2011). "Ifoda etish va tozalash 15N- va 13NMR asosidagi strukturaviy tahlil uchun odamning altsgeymerning b-amiloid peptidi bo'lgan 40-qoldiqli C-izotopi ". Proteinlarni ifoda etish va tozalash. 79 (1): 16–24. doi:10.1016 / j.pep.2011.05.012. PMC 3134129. PMID 21640828.
- ^ Tinta T, Christianen LS, Konrad A, Liberles DA, Turk V, Munch-Petersen B, Pishkur J, Klauzen AR (iyun 2012). "Timidin va deoksiadenozin uchun o'ziga xos xususiyati yuqori bo'lgan ikkita suv bakteriyasida deoksiribonukleozid kinazalar". FEMS Mikrobiologiya xatlari. 331 (2): 120–7. doi:10.1111 / j.1574-6968.2012.02565.x. PMID 22462611.
Tashqi havolalar
- Glutatyon haqida umumiy ma'lumot S-Transferazlar
- Glutation + S-Transferaza AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)
- EC 2.5.1.18
- GST sintezi oqsillarini tayyorlash
- GST Gen Fusion System qo'llanmasi
