Lityum sulfat - Lithium sulfate
 | |
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Lityum sulfat | |
| Boshqa ismlar Lityum sulfat | |
| Identifikatorlar | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.030.734 |
PubChem CID | |
| RTECS raqami |
|
| UNII |
|
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari[1] | |
| Li2SO4 | |
| Molyar massa | 109,94 g / mol |
| Tashqi ko'rinish | Oq kristalli qattiq, gigroskopik |
| Zichlik | 2,221 g / sm3 (suvsiz) 2,06 g / sm3 (monohidrat) |
| Erish nuqtasi | 859 ° C (1,578 ° F; 1,132 K) |
| Qaynatish nuqtasi | 1,377 ° C (2,511 ° F; 1,650 K) |
| monohidrat: 34,9 g / 100 ml (25 ° C) 29,2 g / 100 ml (100 ° C) | |
| Eriydiganlik | mutlaq erimaydi etanol, aseton va piridin |
| −-40.0·10−6 sm3/ mol | |
Sinishi ko'rsatkichi (nD.) | 1.465 (β-shakl) |
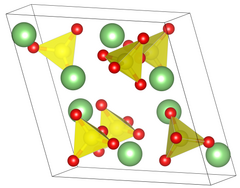
| Tuzilishi[2] | |
| Ibtidoiy monoklinik | |
| P 21/ a, № 14 | |
a = 8,239 Å, b = 4.954 Å, v = 8.474 Å a = 90 °, ph = 107.98 °, ph = 90 °[2] | |
Panjara hajmi (V) | 328.9 Å3 |
Formulalar (Z) | 4 |
| Tetraedral oltingugurtda | |
| Termokimyo | |
Issiqlik quvvati (C) | 1,07 J / g K |
Std molar entropiya (S | 113 J / mol K |
Std entalpiyasi shakllanish (ΔfH⦵298) | -1436,37 kJ / mol |
Gibbs bepul energiya (ΔfG˚) | -1324,7 kJ / mol |
| Xavf | |
| NFPA 704 (olov olmos) | |
| O'lim dozasi yoki konsentratsiyasi (LD, LC): | |
LD50 (o'rtacha doz ) | 613 mg / kg (kalamush, og'iz orqali)[3] |
| Tegishli birikmalar | |
Boshqalar kationlar | Natriy sulfat Kaliy sulfat |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Lityum sulfat bilan oq noorganik tuzdir formula Li2SO4. Bu lityum tuz ning sulfat kislota.
Xususiyatlari
Jismoniy xususiyatlar
Lityum sulfat bu eriydi suvda, odatdagidek haroratga nisbatan eruvchanlik tendentsiyasiga rioya qilmasa ham - suvning eruvchanligi harorat oshishi bilan pasayadi, chunki uning erishi ekzotermik jarayondir. Ushbu xususiyat ozchilik bilan bo'lishiladi noorganik birikmalar kabi lantanoid sulfatlar.
Lityum sulfat kristallari pyezoelektrik, ultratovush tipidagi buzilmaydigan sinovlarda ham qo'llaniladi, chunki ular juda samarali ovoz qabul qiluvchilardir. Biroq, ular suvda eruvchanligi sababli ushbu dasturda azob chekishadi.
Beri bor gigroskopik xususiyatlar, lityum sulfatning eng keng tarqalgan shakli bu lityum sulfat monohidrat. Suvsiz lityum sulfatning zichligi 2,22 g / sm3 Ammo suvsiz lityum sulfatni tortish og'ir bo'lishi mumkin, chunki uni atmosferada etishmaydigan suvda bajarish kerak.
Lityum sulfat bor pyroelektrik xususiyatlar. Suvli lityum sulfat qizdirilganda elektr o'tkazuvchanligi ham oshadi. Lityum sulfatning molyarligi ham elektr o'tkazuvchanligida rol o'ynaydi; optimal o'tkazuvchanlikka 2M da erishiladi va keyin pasayadi.[4]
Qattiq lityum sulfat suvda eritilganda u endotermik bo'ladi ajratish. Bu boshqacha natriy sulfat ekzotermik ajralishga ega. Ajratish energiyasining aniq miqdorini aniqlash qiyin, chunki u qo'shilgan tuz mollariga nisbatan ko'rinadi. Eritilgan lityum sulfatning oz miqdori katta miqdordagi haroratga qaraganda ancha katta o'zgaradi.[5]
Kristal xususiyatlari
Lityum sulfat ikki xilga ega kristalli fazalar. Umumiy II bosqichda lityum sulfat sfenoidalga ega monoklinik kristal a = 8.23Å b = 4.95Å c = 8.47Å β = 107.98 ° uzunlikdagi tizim. Lityum sulfatni 130 passed dan qizdirganda u suvsiz holatga o'tadi, lekin kristalli tuzilishini saqlaydi. II fazadan I fazaga o'tish sodir bo'lganda, 575 is gacha emas, balki kristalli struktura markazlashtirilgan yuzga o'zgaradi. kubik kristalli tizim, chekka uzunligi 7.07Å.[6] Ushbu o'zgarishlar o'zgarishi paytida lityum sulfatning zichligi 2,22 dan 2,07 g / sm gacha o'zgaradi3.[7]
Foydalanadi
Lityum sulfat davolash uchun ishlatiladi bipolyar buzilish (qarang lityum farmakologiya ).
Lityum sulfat ion o'tkazuvchan ko'zoynaklarning potentsial tarkibiy qismi sifatida o'rganiladi. Shaffof o'tkazuvchi film Quyosh panellari va batareyaning yangi klassi uchun potentsial kabi dasturlarda ishlatilgani uchun juda o'rganilgan mavzu. Ushbu dasturlarda yuqori lityum tarkibiga ega bo'lish muhimdir; ko'proq ma'lum bo'lgan ikkilik lityum borat (Li₂O · B₂O₃) yuqori lityum konsentrasiyalari bilan olinishi qiyin va uni saqlab qolish qiyin, chunki u gigroskopikdir. Tizimga lityum sulfat qo'shilsa, osongina ishlab chiqariladigan, barqaror va yuqori lityum konsentratsiyali shisha hosil bo'lishi mumkin. Hozirgi shaffof ionli o'tkazuvchi plyonkalarning aksariyati organik plastmassalardan tayyorlangan bo'lib, arzon va barqaror noorganik shishani ishlab chiqarish juda yaxshi bo'lar edi.[8]
Lityum sulfat qo'shimcha sifatida sinovdan o'tgan Portlend tsement ijobiy natijalar bilan davolanishni tezlashtirish. Lityum sulfat hidratsiya reaktsiyasini tezlashtirishga xizmat qiladi (qarang) Tsement ) bu davolanish vaqtini pasaytiradi. Qattiqlashuv vaqtining pasayishi xavotirga soladigan narsa - bu oxirgi mahsulotning mustahkamligi, ammo sinovdan o'tkazilganda lityum sulfat bilan qo'shilgan Portlend tsementning kuchi sezilarli darajada pasaygani yo'q.[9]
Dori-darmon
Lityum (Li) psixiatriyada davolash uchun ishlatiladi mani, endogen depressiya va psixoz; shuningdek, shizofreniya kasalligini davolash uchun. Odatda lityum karbonat (Li₂CO₃) qo'llaniladi, lekin ba'zida lityum sitrat (Li₃C6H5O7), lityum sulfat yoki lityum oksibutirat alternativ sifatida ishlatiladi.[10] Li metabolizmga uchramaydi. Li kimyoviy o'xshashligi tufayli natriy (Na +) va kaliy (K +), bu moddalar uchun biokimyoviy yo'llar bilan ta'sir qilishi yoki aralashishi mumkin va bu kationlarni tananing hujayra ichidagi yoki hujayradan tashqaridagi bo'linmalaridan siqib chiqarishi mumkin. Li asab va mushak hujayralaridan, faol bo'lmagan natriy nasos yordamida tashiladigandek tuyuladi.
Lityum sulfat tezkor xususiyatga ega oshqozon-ichak assimilyatsiya darajasi (bir necha daqiqa ichida) va tabletkalarni yoki suyuqlik shaklida og'iz orqali yuborishdan keyin to'liq.[10] U tezda jigar va buyraklarga tarqaladi, ammo tana muvozanatiga erishish uchun 8-10 kun kerak bo'ladi. Li ko'plab metabolik va neyroendokrin o'zgarishlarni keltirib chiqaradi, ammo aniq biron bir harakat usulini qo'llab-quvvatlamaydi.[10] Masalan, Li neyroxormonlar bilan, xususan biogen aminlar, serotonin (5-gidroksi triptamin) va noradrenalin, bu psixiatrik kasalliklarda foydali ta'sirning ehtimoliy mexanizmini ta'minlaydi, masalan. manialar. In CNS, Li asab qo'zg'alishi, sinaptik uzatish va neyronlarning metabolizmiga ta'sir qiladi.[11] Li serotoninerjik neyrotranslyatsiyani barqarorlashtiradi.
Reaksiyalar
Lityum sulfat organik kimyo sintezida ishlatilgan. Lityum sulfat 320 ℃ dan 370 a gacha bo'lgan oraliqda 100% ga yaqin hosil beradigan n-butil bromidni 1-butenga almashtirishda eliminatsiya reaktsiyasi uchun katalizator sifatida foydalanilmoqda. Ushbu reaksiya rentabelligi keskin o'zgaradi, agar bu diapazondan tashqarida qizdirilsa, 2-butenning yuqori rentabelligi hosil bo'ladi.[12]
Adabiyotlar
- ^ Patnaik, Pradyot (2002). Anorganik kimyoviy moddalar bo'yicha qo'llanma. McGraw-Hill. ISBN 0-07-049439-8.
- ^ a b doi:10.1107 / S0567740876004433
- ^ Chambers, Maykl. "ChemIDplus - 10377-48-7 - INHCSSUBVCNVSK-UHFFFAOYSA-L - Lityum sulfat - Shu kabi tuzilmalarni qidirish, sinonimlar, formulalar, manbalar havolalari va boshqa kimyoviy ma'lumotlar". chem.sis.nlm.nih.gov. Olingan 12 oktyabr 2018.
- ^ Anxel C.; Sobron F.; Xose I. Lityum sulfatning suvli eritmalarining zichligi, yopishqoqligi va elektr o'tkazuvchanligi. J. Chem. Ing. 1995, 40, 987-991
- ^ Tomson T. P.; Smit D. E.; Yog'och R. H. Na2SO4 va Si2SO4 J Chem suvli suyultirish entalpiyasi. Ing. 1974, 19, 386-388
- ^ Rao C. N. R.; Prakash B. Anorganik sulfatlar, fosfatlar, perxloratlar va xromatlardagi kristalli strukturaning o'zgarishi. NSRDS. 1975, 56, 2-12
- ^ Fordlend, T.; Keog, M. J. Lityum sulfatning yuqori haroratli modifikatsiyasi tuzilishi. 1957, 565-567
- ^ E. I. Kimyogarlar; M. A. Karakassidlar; G. D. Xrizikos. Lityum sulfat asosidagi tez ionli o'tkazuvchan borat ko'zoynaklarini tebranish asosida o'rganish. J. Fiz. Kimyoviy. 1986, 90 4528-4533
- ^ Yuhay D .; O'zgaruvchan Z.; Xiaosheng W. Portlend tsement pastasining xususiyatlariga litiy sulfat qo'shilishining ta'siri. Qurilish va qurilish 2014, 50, 457-462
- ^ a b v Haddad, LM, Vinchester, JF Zaharlanish va giyohvand moddalarning haddan tashqari dozasini klinik boshqarish. 1990 yil 2-nashr, 656-665
- ^ Poiseks, Thomson Micromedex 2005 yil
- ^ Noller, H., Roza-Brusin, M. va Andréu, P. (1967), 1-butenni lityum sulfat bilan eliminatsiya katalizatori sifatida stereoelektiv sintezi. Angew. Kimyoviy. Int. Ed. Ingl., 6: 170–171. doi: 10.1002 / anie.196701702


